联川 Cell 用户文章 :单细胞 +蛋白代谢等多组学联合揭示小肠营养双向供给驱动小肠生理功能机制研究
一、研究背景
小肠是重要的消化器官,具有营养吸收、激素分泌、与肠道微生物群的相互作用以及保护宿主免受病原体侵害等功能。 [1]小肠固有层包含中央乳糜管以及毛细血管网,可将吸收的营养物质和分泌的激素输送到全身循环。同时,浆膜侧的血管作为另一个营养供给侧,为小肠提供来自宿主营养储存的系统代谢物。 [2,3] 这种双向营养供给策略为小肠提供了独特的营养环境,并且对小肠不同空间区域和细胞类型具有显著特异的生理功能影响。然而,这两种供应系统对小肠生理机制贡献的差异还尚不清楚。
2024年 10 月 18 日,浙江大学医学院附属邵逸夫医院王迪教授联合浙江大学爱丁堡大学联合学院研究员刘琬璐在 Cell 杂志发表题为 A two-front nutrient supply environment fuels small intestinal physiology through differential regulation of nutrient absorption and host defense 的研究论文(图 1)。 [4] 该研究系统性绘制了高分辨率的小肠双向营养供给环境图谱,可视化营养吸收的时空动力学和细胞类型以及绒毛内不同区域代谢的偏好性。总之,这项研究提高了我们对小肠如何受到其独特营养环境的时空调节的理解。
本研究中的单细胞转录组测序服务由联川生物提供 !

图 1 相关研究论文
二、实验方案设计
为了表征双向营养供给系统的生理影响,研究人员设计了三种小鼠喂养策略(图 2.1左):
1. 假手术组( sham):正常自由进食,同时静脉给予生理盐水;
2. 肠外营养组( TPN):禁食,同时静脉给予肠外营养液;
3. 禁食组( starvation):禁食,同时静脉给予生理盐水。
其中假手术组和肠外营养组对比,能反映来自肠内侧营养供给的生理影响。而肠外营养组和禁食组相比,能反映来自浆膜侧营养供给的生理影响。
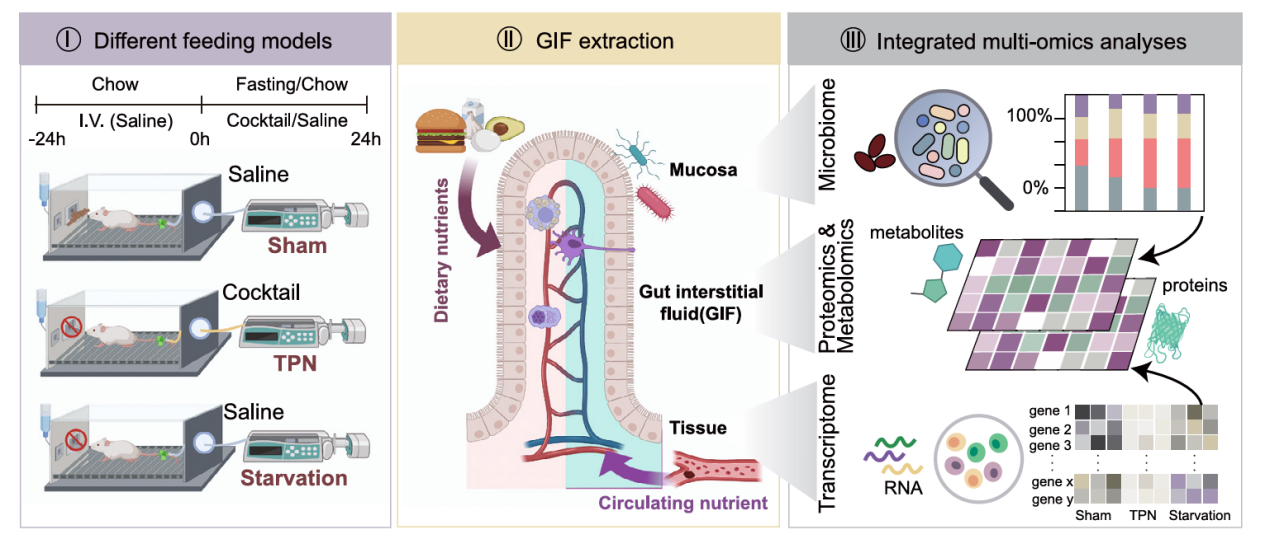
图 2.1 双向营养供给实验模型及 GIF 、粘膜和组织的多组学整合网络分析
肠间质液( GIF)作为积聚在小肠组织内部的近端细胞外液,代表了内部微环境和各种细胞类型之间的通讯。因此研究人员同时设计了提取 GIF 的新实验策略(图 2.1 中)。最后基于转录组、蛋白代谢组和微生物组的多组学数据联合分析,从而对小肠双向营养供给系统进行系统性描述(图 2.1 右)。
三、研究结果
1. 小肠双向营养供给系统图谱
首先研究人员发现,在 GIF代谢物中,肠内侧优先富含脂质相关代谢物,而浆膜侧则积累与碳水化合物和有机酸相关的代谢物。而这些代谢物很大一部分是由微生物代谢产生的(图 3.1 B) 。乳杆菌是二级胆汁酸的重要来源参与脂质吸收和代谢。值得注意的是,空肠组织中肠内供给侧富含乳杆菌和牛磺酸(图 3.1 C) 。乳杆菌定群诱导 GIF 中各种胆汁酸的丰度显着增加(图 3.1 D ),同时伴有脂质吸收能力的增加(图 3.1 E,F )。而浆膜侧则富含副拟杆菌属及其相关代谢物十八碳三烯酸(图 3.1 C )。以上结果表明,在不同的营养供给条件下,微生物群对小肠代谢环境的作用各不相同。此外,通过整合微生物组和转录组等多组学数据,肠内侧对脂质吸收和代谢、上皮细胞的屏障功能以及激素分泌等功能有影响,而浆膜侧对维持肠组织结构和免疫调节具有突出贡献(图 3.1 G )。综上,小肠双向营养供给系统在塑造和影响小肠生理的许多方面存在显著的异质性。
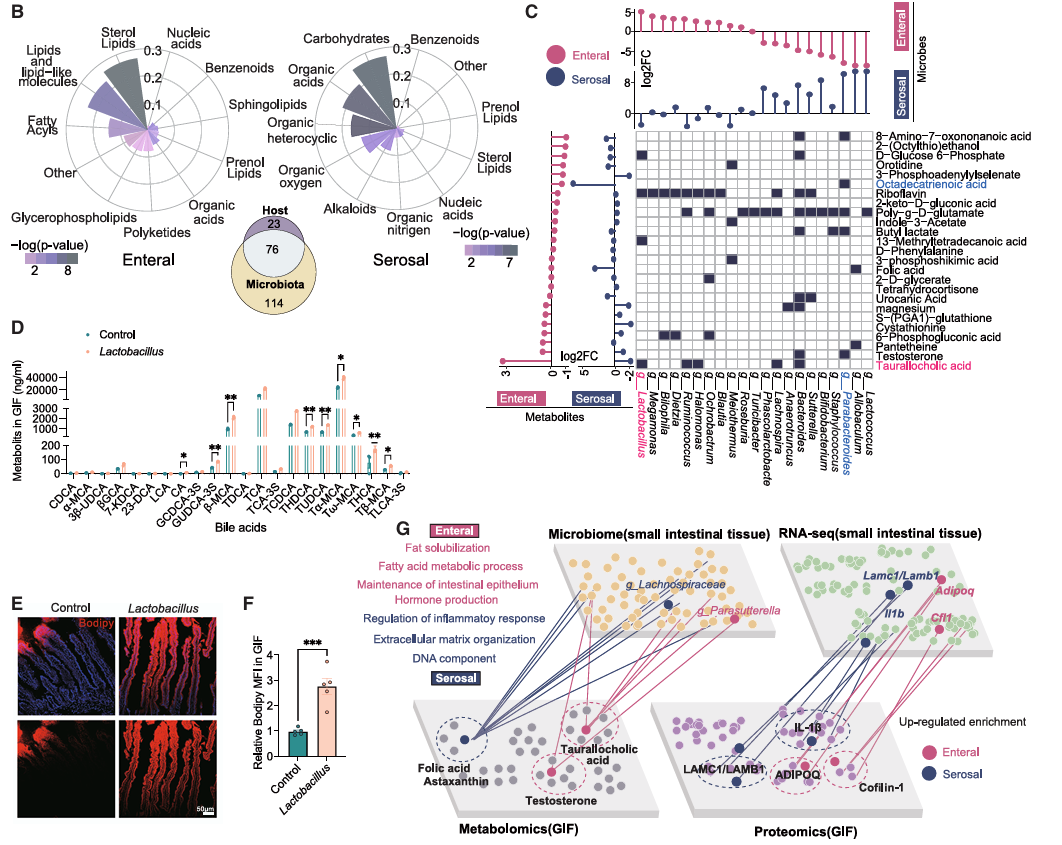
图 3.1 小肠双向营养供给系统图谱
2. 小肠吸收营养物质的时空特征
随后,为了探究肠道和浆膜侧营养物质进入小肠的动态过程,研究人员首先给小鼠灌胃注射了荧光标记的类似物 2-NBDG(标记葡萄糖)、 Cy3- 胆固醇和 Cy5- 谷氨酰胺,并分别测量了血清和 GIF 样品中荧光信号的首次出现时间和强度(图 3.2 A )。通过对荧光信号的检测表明,从肠侧吸收的营养物质通过上皮和固有层进入体循环(图 3.2 B )。小肠绒毛对胆固醇和谷氨酰胺的吸收稍晚于对葡萄糖的吸收(图 3.2 C )。 2-NBDG 的吸收几乎沿绒毛均匀分布,但胆固醇的吸收主要发生在绒毛顶端 (图 3.2 C,D )。而吸收的谷氨酰胺似乎特别积聚在某些特定的上皮细胞中(图 3.2 C,D,G )。通过上皮细胞类型 marker 检测,发现谷氨酰胺主要在杯状细胞和簇状细胞中优先积累(图 3.1 H )。而通过静脉注射至小肠的营养物质,其荧光信号出现后迅速消失,表明被小肠局部细胞吸收(图 3.2 E )。此外,由浆膜侧驱动的营养物质的吸收模式相近,沿着绒毛没有明显的区域或细胞类型特异性(图 3.2 F )。以上结果表明,小肠对双向系统的营养吸收模式具有显著差异。
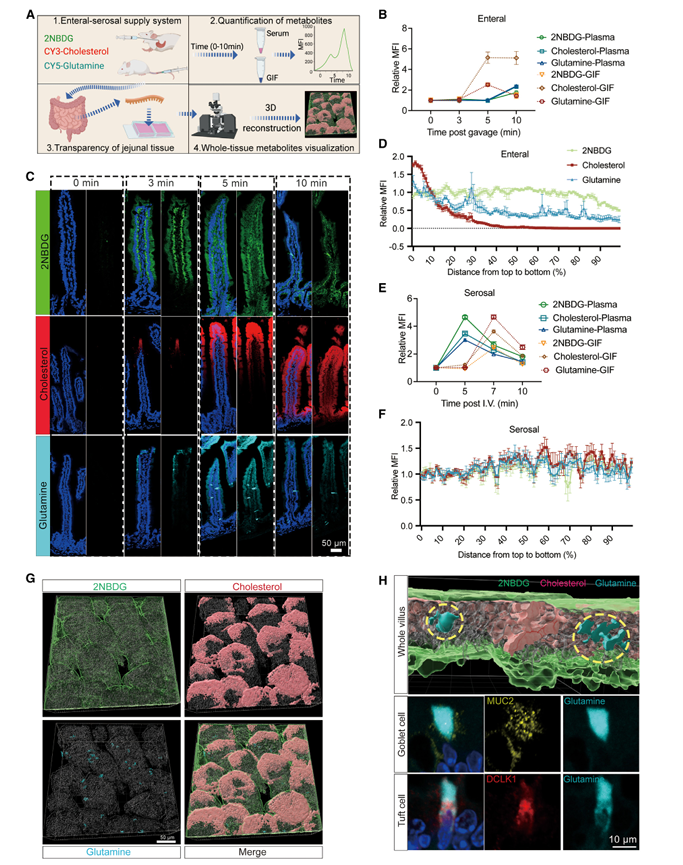
图 3.2 小肠吸收营养物质的时空特征
3. 绒毛内空间代谢和功能异质性
小肠生理上具有功能和代谢的异质性及专一性。因此,研究人员假设我们认为,营养吸收的差异赋予了小肠显著的异质性代谢环境,以支持不同细胞类型的特定功能。结果表明,在 sham组中,与邻近的肠细胞相比,杯状细胞表现出更高的谷氨酰胺积累(图 3.3 B ),而 TPN 中的这种积累显着减少, starvation 组中进一步减少(图 3.3 C )。在用不含谷氨酰胺的饲料喂养小鼠( Gln 组)后,其小肠绒毛间黏液的产生大大减少(图 3.3 D,E )。通过透明技术和共聚焦三维成像技术,显示 NC 组的微球被绒毛外的黏液层阻挡,而 Gln 组的微球直接穿过绒毛间隙,与绒毛表面直接接触。黏液在 Gln 组小鼠滤泡间隙中的不存在(图 3.3 H ),这反过来又导致小鼠肠道黏液层中的细菌数量显著减少(图 3.3 I,J )。此外,被病原体感染后, Gln 组小鼠小肠内病原菌数量明显较高(图 3.3 K,L )。这些结果强调了膳食谷氨酰胺摄入在促进杯状细胞产生粘液方面的关键作用。
接下来,研究人员探究不同喂养模式对特定区域代谢特征的影响。根据 H&E 染色,将空肠组织分为四个不同的亚区:隐窝、固有层、上皮和管腔区(图 3.3 M )。两个营养供给侧在所有亚区都产生了大量差异富集代谢物( DEMs )(图 3.3 N )。随后对上调的 DEMs 进行的富集分析表明,对肠道营养物的反应中,与脂质代谢相关的通路在所有亚区中都显著富集(图 3.3 O )。进一步分析确定了具有明显代谢特征的七个聚类,三个喂养组在这些聚类的空间分布上表现出明显差异(图 3.3 P )。随后对各聚类特征代谢物的分布研究表明,绒毛内代谢和功能在空间尺度上具有显著异质性(图 3.3 P-T )。
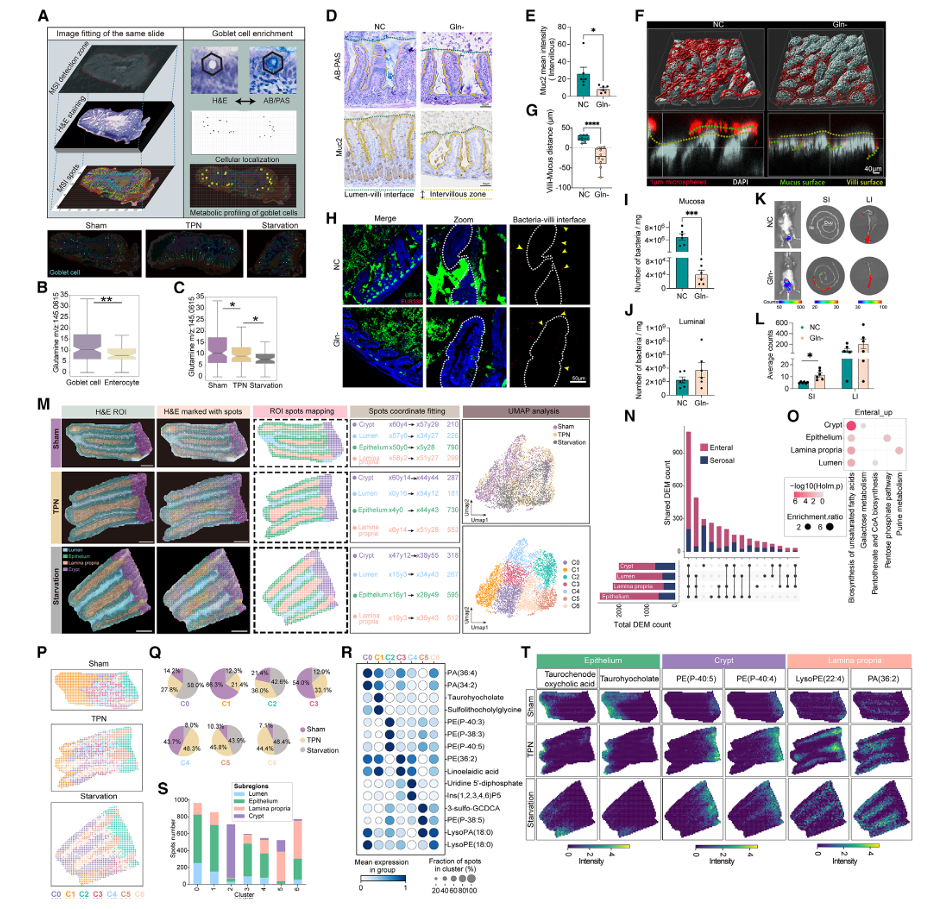
图 3.3 绒毛内空间代谢和功能异质性
4. 单细胞测序探究双向营养供给系统差异
接下来,研究人员对 sham、 TPN 和饥饿条件下小鼠空肠样本进行 scRNA-seq 。共获得了 41,632 个高质量细胞,并经过聚类注释,得到了包括 5 种细胞大类的 18 种已知的细胞类型 ( 图 3.4 A) 。这三种进食模式对各种细胞类型的比例产生明显不同的影响(图 3.4 B ),表明不同细胞类型对营养供给状态的反应存在差异。对每种细胞类型的差异表达基因( DEG )分析表明,肠侧的营养物质总体上对多种细胞类型表现出更大的影响,肠上皮细胞是受影响最大的细胞类型。通过定义 ” 肠内侧得分 “ 和 ” 浆膜侧得分 “ ,去量化每种营养供给侧的不同影响。结果表明,肠上皮细胞表现出最高的肠内侧得分(图 3.4 D ),表明其在响应肠道营养供给方面发挥了重要作用。相比之下,壁细胞和内皮细胞的浆膜侧得分较高(图 3.4 D ),这可能反映了其作为血管的组成部分,促进了浆膜侧的营养运输。富集结果表明,肠内侧诱导的 DEGs 显著富集于与膳食有机分子氧化相关的通路,而浆膜侧 DEGs 则为细胞周期的调节提供支持(图 3.4 E,F )。随后对肠内侧和浆膜侧中转运蛋白基因的表达谱分析也揭示了这两种营养供给系统的差异营养吸收模式(图 3.4 G-J )。
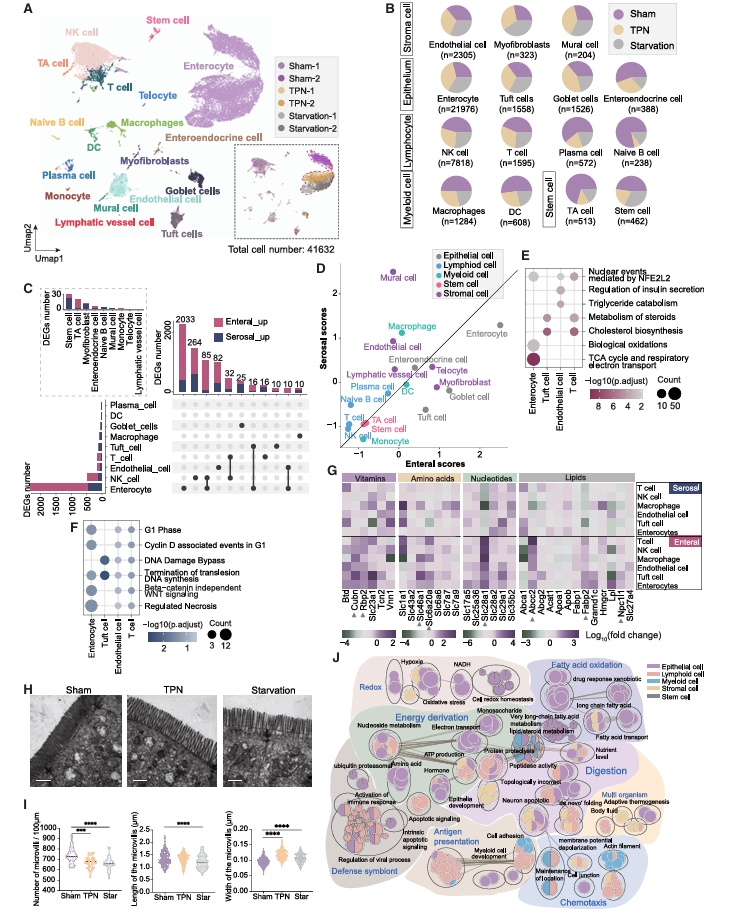
图 3.4 单细胞测序探究双向营养供给系统差异
5. 双向营养供给侧决定上皮细胞的空间分区功能
小肠上皮组织精细,需要沿着绒毛轴精确调节肠上皮细胞功能的空间分区。研究人员发现 sham、 TPN 和饥饿组的肠上皮细胞转录组存在显著差异(图 3.5 A )。对底部、中部和顶部肠上皮细胞中 DEGs 的分析表明,与屏障功能有关的生物学功能,如 “ 细胞连接组装 ” 和 “ 细胞 - 细胞连接组织 ” ,在绒毛顶部肠上皮细胞中对肠内侧营养供应的反应显著富集,但浆膜侧则不显著富集(图 3.5 B ), 表明绒毛顶部还需要在不同的营养供应条件下对其屏障功能进行动态调节。 基于 GIF 代谢组学数据,研究人员发现细胞松弛素 -H ( CyH )在 GIF 样本中因肠内营养供应而略有下降,但因浆膜侧供应而显著增加(图 3.5 C )。 TPN 处理后 24h , GIF 中 CyH 的含量以及小肠渗透性显著增加(图 3.5 D,E )。有趣的是,右旋糖酐硫酸钠( DSS )对屏障功能的破坏大大增加了小肠的通透性,而 CyH 的量却没有变化(图 3.5 D,E ),表明 TPN 诱导的 CyH 积累可能是肠屏障受损的上游事件,而不是结果。此外,通过透射电镜以及免疫荧光染色证实上述结论(图 3.5 F-I )。
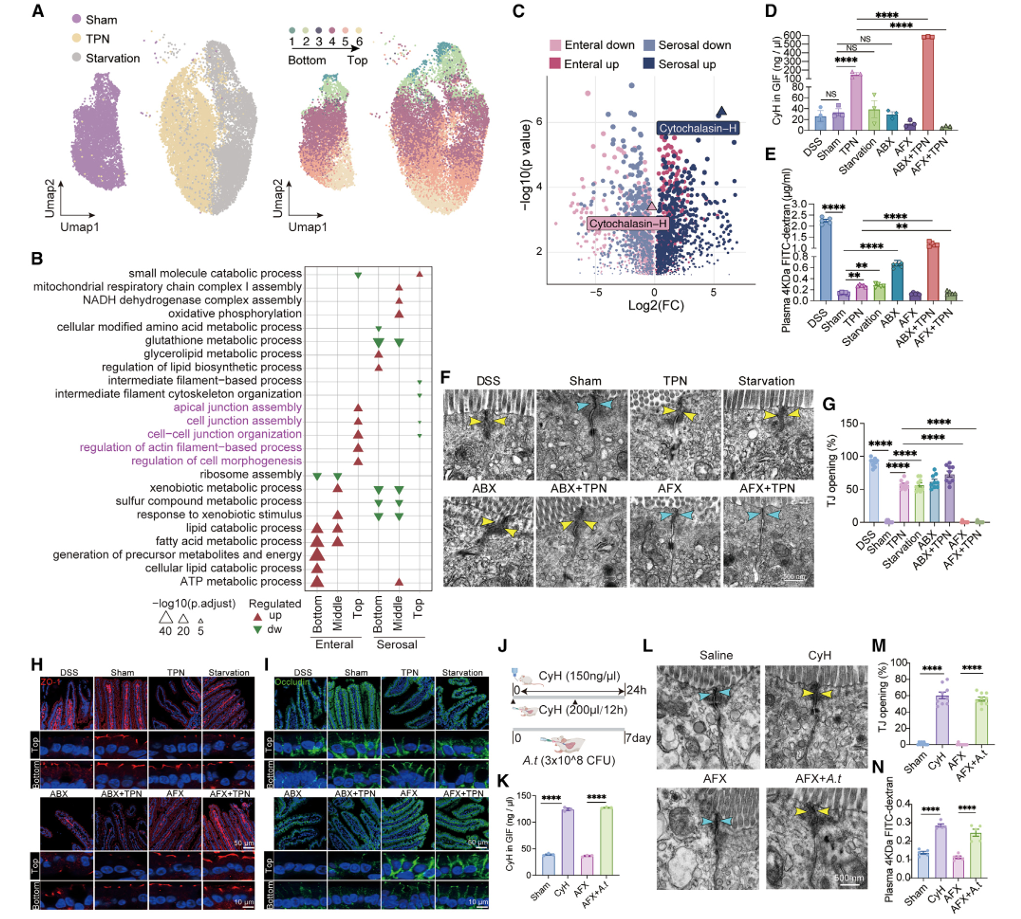
图 3.5 双向营养供给侧决定上皮细胞的空间分区功能
6. 特定时间段内缺乏肠内营养物质会重塑空间组织的吸收功能并扰乱小肠中的脂质吸收
接下来,研究人员探讨了肠内营养剥夺如何诱导小肠营养吸收的动态适应(图 3.6 A)。通过 2D 和 3D 图像分析,发现在接受 TPN 的小鼠绒毛内,胆固醇和谷氨酰胺的吸收在第 16h 达到峰值,而观察到 2-NBDG 吸收的变化极小(图 3.6 B,C )。由于 16 小时内缺乏肠内营养素( 0h-16h )而导致营养物质过度吸收,与人们日常不吃早餐的不健康生活方式相似,因此,为了研究模仿不吃早餐( BSF )的喂食模式的相对长期影响,研究人员将小鼠每日进食时间限制在 16h-24h 的一致窗口内,而对照组的喂食窗口设置为 12h-24h (图 3.6 D )。结果显示关键胆固醇转运蛋白基因 Npc1l1 的表达水平以及脂肪酸转运蛋白基因 Fabp2 的表达水平因 BSF 而显著增加(图 3.6 E )。而模拟不吃午餐( LSF )以及不吃晚餐( DSF )组中 Npc1l1 的表达逐渐减弱(图 3.6 F ),表明 BSF 时间段对营养吸收的适应性有更大的影响。 ATAC 以及 Bulk-RNA 数据显示,三组进食组与对照组均存在显著差异(图 3.6 G )。与 LSF 和 DSF 组相比, BSF 在染色质开放区( OCR )特异性峰数量总体显着增加(图 3.6 H )。通过分析转录因子( TF )结合基序,发现由脂肪酸激活并参与脂质代谢的关键 TF ,包括过氧化物酶体增殖物激活受体 ɑ ( PPARɑ )及视色素 x 受体( RXR ),显著富集在 BSF 特异的 OCR 区(图 3.6 I )。随后的研究发现,在 Npc1l1 转录起始位点上游, BSF 诱导的 PPARɑ 结合在基序结合位点 1 显著增加,而在 LSF 及 DSF 组中则没有这种结合(图 3.6 J-M )。后续实验表明,即使转变正常饮食,特定时间段内的一段时间进食混乱可能会导致小肠营养吸收的持续变化(图 3.6 N-R )。总之,早餐特定时间段内的进食中断通过重塑染色质可及性和招募相关转录因子,引发小肠上皮脂质吸收的持续适应性变化。
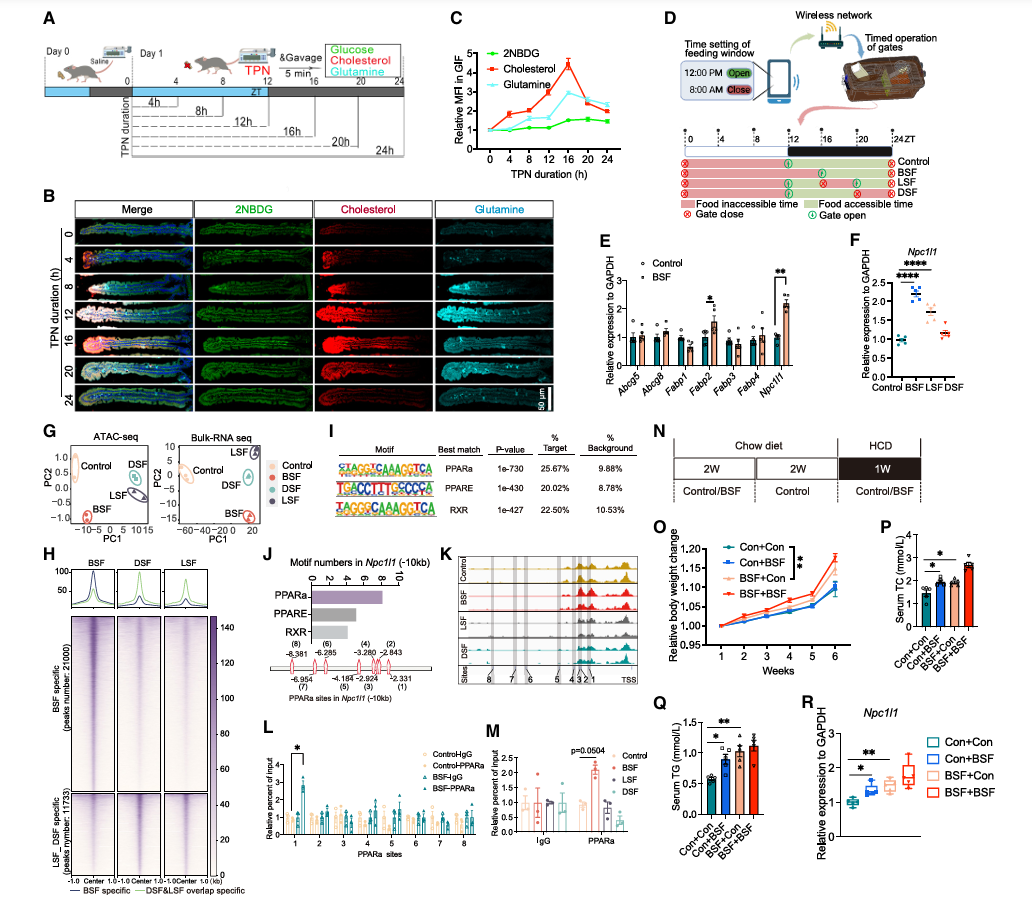
图 3.6 特定时间段内缺乏肠内营养物质会重塑空间组织的吸收功能并扰乱小肠中的脂质吸收
7. 不吃早餐导致系统代谢稳态受损
不吃早餐与心血管疾病发病风险增加有关,但其潜在机制仍不清楚。鉴于过多的脂质摄入和积累在动脉粥样硬化等心血管疾病的病理过程中起着至关重要的作用,研究人员以 BSF或对照喂养模式向易动脉粥样硬化的 Apoe 缺陷( Apoe -/- )小鼠喂食高胆固醇饲料 10 周(图 3.7 A )。结果显示,在 BSF 小鼠中, Npc1l1 在上皮中的表达显著升高,伴随着内吞作用的显著提升,表明 BSF 条件下小肠中胆固醇吸收增强(图 3.7 B )。虽然食物摄入量相当,但是 BSF 会导致血清中 甘油三酯 TG 、总胆固醇 TC 和低密度脂蛋白胆固醇 (LDL-C) 水平升高,同时降低粪便中排出的胆固醇水平(图 3.7 C-E )。而注射 Npc1l1 抑制剂 ezetimibe 后以上表型均得到恢复(图 3.7 B,D,E )。最后研究人员发现 BSF 会导致动脉粥样硬化病变的面积显著增加,并在这些区域积累更多的脂质和胶原蛋白,而 ezetimibe 能防止这些病变的发生(图 3.7 F-I )。
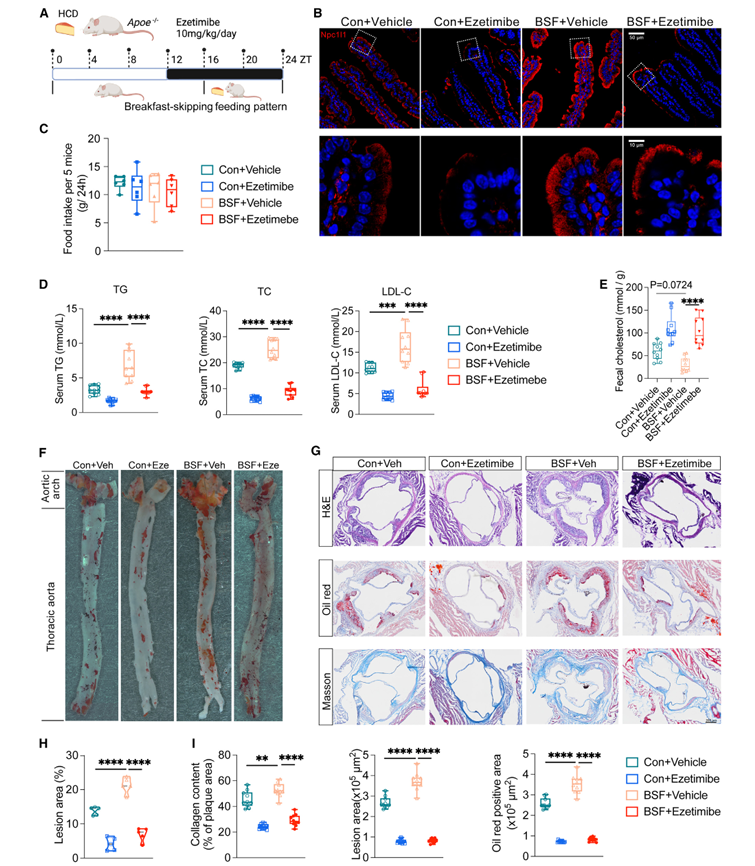
图 3.7 不吃早餐导致系统代谢稳态受损
四、总结
在这项研究中,研究人员绘制了小肠双向营养供给系统的综合性高分辨率图谱和营养供给环境的多层调节网络。利用单细胞测序和空间代谢组学等方法,研究人员可视化了细胞类型特异性营养物质吸收的时空动态过程,以及绒毛内特定区域的代谢异质性。而不吃早餐会诱导上皮对脂质吸收的记忆,从而增加患代谢性疾病的风险。这些对独特营养供给环境的新发现将有助于我们进一步了解小肠协调饮食等过程,以及不规律的饮食模式导致疾病发生发展的潜在机制。
参考文献
【1】 Crosnier, C., Stamataki, D., and Lewis, J. (2006). Organizing cell renewal in the intestine: stem cells, signals and combinatorial control. Nat. Rev. Genet. 7, 349–359. https://doi.org/10.1038/nrg1840.
【2】 Ko, C.W., Qu, J., Black, D.D., and Tso, P. (2020). Regulation of intestinal lipid metabolism: current concepts and relevance to disease. Nat. Rev. Gastroenterol. Hepatol. 17, 169–183. https://doi.org/10.1038/s41575-019-0250-7.
【3】 Alderweireldt, E., Grootaert, C., De Wever, O., and Van Camp, J. (2022). A two-front nutritional environment fuels colorectal cancer: perspectives for dietary intervention. Trends Endocrinol. Metab. 33, 105–119. https://doi.org/10.1016/j.tem.2021.11.002.
【4】 Zhang, J., Tian, R., Liu, J., Yuan, J., Zhang, S., Chi, Z., Yu, W., Yu, Q., Wang, Z., Chen, S., Li, M., Yang, D., Hu, T., Deng, Q., Lu, X., Yang, Y., Zhou, R., Zhang, X., Liu, W., & Wang, D. (2024). A two-front nutrient supply environment fuels small intestinal physiology through differential regulation of nutrient absorption and host defense. Cell , S0092-8674(24)00903-6. Advance online publication. https://doi.org/10.1016/j.cell.2024.08.012.
