陈益定/潘利强/周云翔|DANCER研究:以生物标志物为“乐谱”,奏响CDK4/6抑制剂新辅助治疗的舞曲
前言
2025年10月11日,《MedComm》(IF=10.7, 中科院/ JCR双一区)在线发表了浙江大学医学院附属第二医院陈益定/潘利强/周云翔教授团队的“DANCER”研究报告,数据表明CDK4/6抑制剂达尔西利联合芳香化酶抑制剂的新辅助治疗方案,在HER2阴性Luminal B型乳腺癌中具有显著的抗肿瘤活性[2周完全细胞周期阻滞(CCCA)率达86.7%]和可控的安全性。通过系列样本采集和多组学分析,研究成功识别了潜在的疗效预测生物标志物,并据此提出了一个全新的“二阶预测框架”。

DANCER研究发表于MedComm
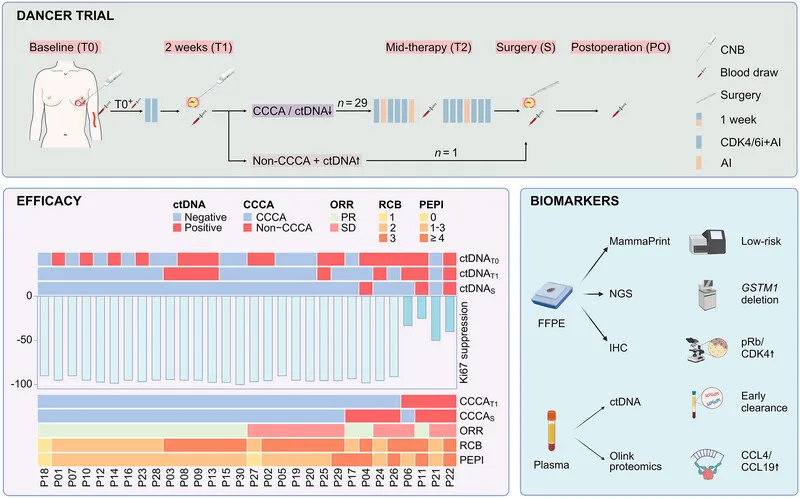
DANCER研究图形摘要
研究背景
HR+/HER2-乳腺癌约占所有乳腺癌病例的70%,是最常见的亚型。尽管新辅助化疗常用于局部晚期患者,但对该亚型疗效有限,且耐受性不佳。近年来,CDK4/6抑制剂联合内分泌治疗在新辅助场景中展现出潜力,成为临床关注的新方向。
达尔西利是由恒瑞医药自主研发的CDK4/6抑制剂。DAWNA系列研究已证实,无论在早期辅助还是晚期一线、二线治疗中,达尔西利联合内分泌治疗均能显著改善HR+/HER2-乳腺癌患者的预后。其中DAWNA-2研究在晚期一线治疗中表现尤为突出,刷新了无进展生存期与客观缓解率的数据记录。
然而,达尔西利在新辅助治疗场景下的疗效与安全性仍需予以确认。与此同时,如何在该场景下实现精准治疗仍面临关键挑战:能否利用循环肿瘤DNA(ctDNA)动态监测实现早期疗效评估与治疗策略调整?多组学分子图谱如何系统揭示药物应答与耐药机制?又能否构建更精准的预测模型以有效识别优势人群?
研究设计
DANCER研究是一项采用ctDNA指导的Ⅱ期临床试验。主要终点是达尔西利联合内分泌治疗两周(T1)后的CCCA(Ki67≤2.7%)率。
主要纳入标准:可手术Ⅰ-Ⅲ期、T≥2cm单侧Luminal B型浸润性乳腺癌(ER≥10%,HER2阴性,且Ki67≥20%和/或PgR<20%)。治疗方案:绝经后患者直接接受新辅助芳香化酶抑制剂(AI)(阿那曲唑 1 mg QD或来曲唑 2.5 mg QD)联合达尔西利(150 mg,用药3周/停药1周)治疗(DAL-AI)。绝经前患者则在DAL-AI治疗前,先接受为期14天(Cycle 0)的AI联合GnRH激动剂导入治疗。
研究采用应答指导的适应性策略。T1时,若患者未达到CCCA且同时出现ctDNA水平升高,则被重新分配至替代治疗方案;其余患者继续完成共15周的 DAL-AI治疗后接受手术(图1A)。
多组学分析:在基线(T0)、Cycle 0结束后(T0+,仅绝经前患者)、T1、治疗中期(T2)、手术时(S)及术后(PO)多个时间点采集血浆样本,用于ctDNA分析与Olink蛋白质组学检测。同时,在T0、T1和S时间点获取肿瘤组织样本,进行体细胞突变谱分析、免疫组织化学分析及 MammaPrint检测(图1B)。
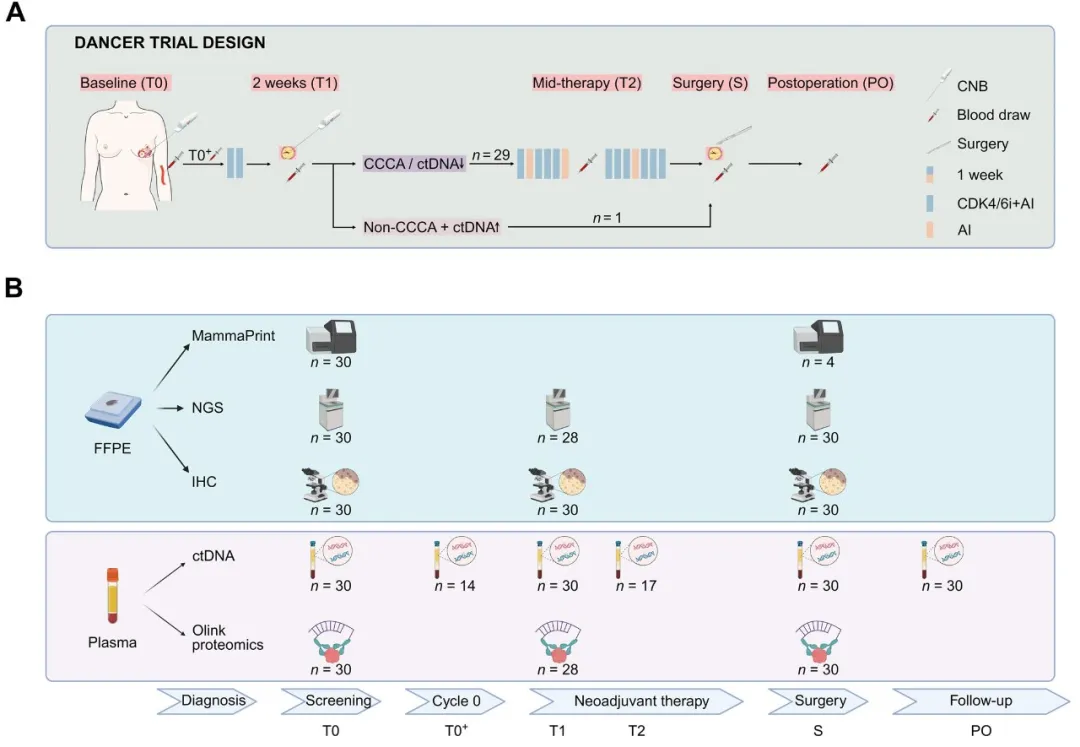
图1. DANCER研究概览
(A)研究设计和样本收集的流程图,T0:基线;T0+:首次服用达尔西利前(仅适用于绝经前患者);T1:达尔西利治疗2周后;T2:达尔西利治疗8周后(治疗中期);S:手术;PO:术后2~4周;(B)生物标志物分析方法。Cycle 0:首次服用达尔西利前的14天周期(仅适用于绝经前患者)
研究结果
1、基线特征
30名患者纳入最终疗效和安全性分析。患者中位年龄为52.5岁,其中46.7%为绝经前状态,ER高表达(>66%)的患者占比达到83.3%。患者的肿瘤负荷和增殖活性相对较高,MRI评估的中位肿瘤大小为33.5毫米(范围:21.3-98.9毫米),83.3%(25/30)的患者伴有淋巴结转移,90.0%(27/30)的患者Ki67水平≥20%。根据MammaPrint和BluePrint检测结果,80.0%(24/30)的肿瘤被归类为基因组高风险;其中1例患者为Basal型,其余23例为Luminal B型。
2 、疗效
达尔西利联合内分泌治疗2周后,患者Ki67水平较基线显著降低,并且86.7%(95% CI,69.3%-96.2%;n=26)的患者达到CCCA,其中4例CCCAT1患者在手术出现Ki67反弹,而另有1例Non-CCCA T1患者呈现延迟的CCCAS反应。术前磁共振评估的总缓解率达60%(18/30),根据术后病理报告,RCB 0-1级的患者比率为3.3%(95% CI,0.1%–17.2%;n=1),乳房病理完全缓解(bpCR)和术前内分泌预后指数(PEPI)0分的患者比例均为6.7%(95% CI,0.8%–22.1%;n=2),没有患者达到总病理完全缓解(tpCR)。
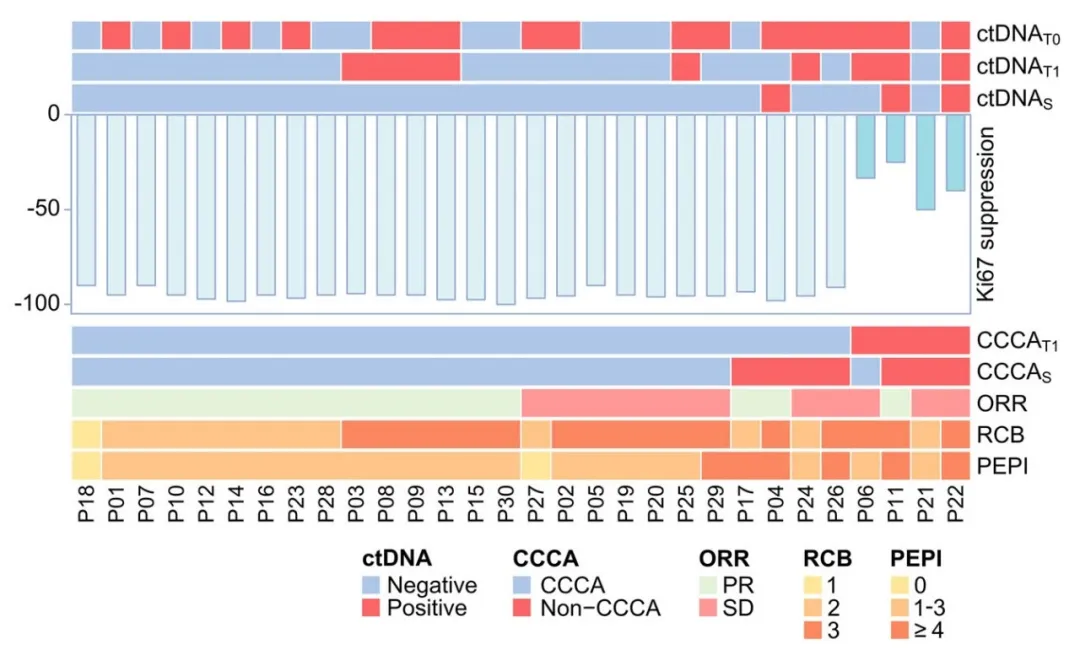
治疗结果
ctDNA阳性率及浓度随治疗推进呈逐步下降趋势。其中1例患者(#22)因在T1时间点出现ctDNA升高且未达CCCA,经医患共同决策后终止研究治疗并转为直接手术;其余29例患者均顺利完成4周期DAL-AI治疗并成功接受手术。
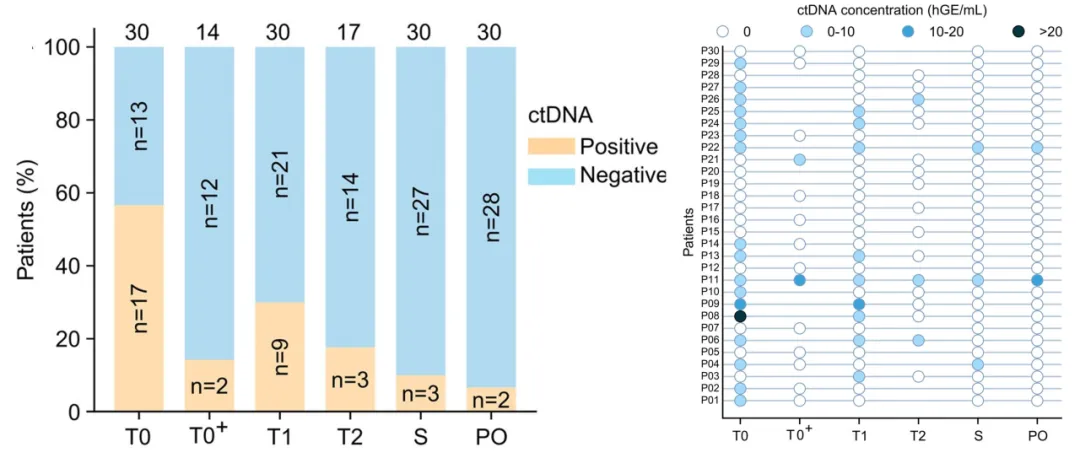
(左)基于每个时间点的可用样本数量,ctDNA呈阳性的患者比例;(右)新辅助治疗期间所有30名患者的个体ctDNA轨迹
3、安全性
所有患者均经历了至少两次治疗期间出现的不良事件(TEAEs),且大多数为1级。最常见的不良事件为血液学毒性和皮疹。20例(66.7%)患者发生了≥3级不良事件,经对症治疗后均未产生临床后果。其中最常见的是中性粒细胞减少(3级:16例,53.3%;4级:4例,13.3%),其次是白细胞减少(3级:11例,36.7%;4级:1例,3.3%)、淋巴细胞减少(3级:1例,3.3%)和口腔炎(3级:1例,3.3%)。未出现任何临床后遗症,也未记录到发热性中性粒细胞减少或5级不良事件。
对毒性发生时间、严重程度与剂量调整数据的综合分析表明,中性粒细胞减少症的早期出现,是其反复发作(≥3级)并最终导致药物减量的一个重要预测因素。
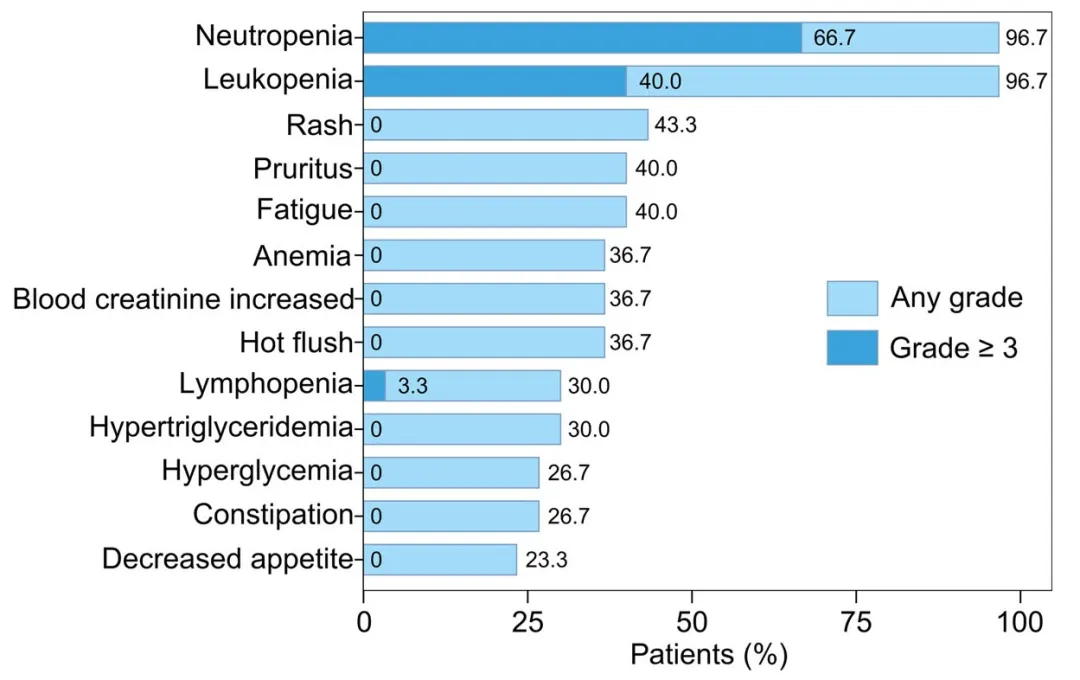
发生率大于20%的TEAEs
4、生物标志物分析
尽管本研究在T1时间点的主要终点CCCA率高达86.7%,但其中一部分患者在新辅助治疗结束时表现出欠佳的影像学和病理学反应。因此,研究者根据Ki67水平反映的增殖抑制情况和MRI评估的肿瘤缩小程度对患者进行分层,以识别更可能对DAL-AI产生最佳反应的肿瘤:在T1和S时均达到CCCA,并且在S时达到影像缓解(PR/CR)的患者被归类为良好应答者(GRs,n=15),其余患者被归类为一般应答者(MRs,n=15)。
分析表明两组患者的基线临床病理特征在组间是平衡的。与MRs相比,手术时GRs表现出显著较低的RCB评分、PEPI评分、组织学分级、Ki67表达和CA153水平;数值较低的ctDNA浓度;显著较高的Miller-Payne分级、肿瘤浸润淋巴细胞水平(TILs)和肿瘤缩小程度。这表明这样的分组是合适且具有临床意义的。随后,研究者进行了深入的标志物探索性分析。

GRs疗效和预后指标显著优于MRs(斜体为数据倒数转换)
Biomarker-ctDNA
GRs在多个时间节点(T0+,T2,S,PO)表现出ctDNA阴性。进一步分析ctDNA阳性的患者数据表明,与T2前就即完成ctDNA清除的患者相比,在T2和/或S时仍保持ctDNA阳性的患者,MR比例显著更高(100.0%[5/5] vs. 42.8%[6/14];p=0.045)。
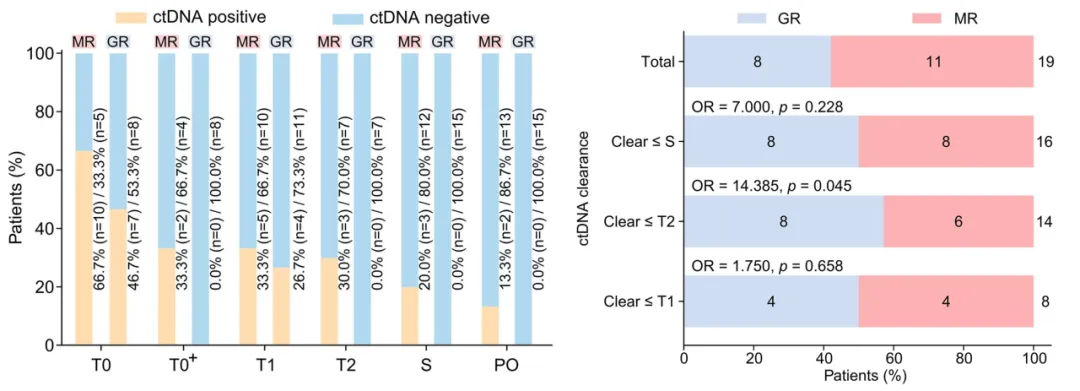
(左)基于每个时间点可用样本数的ctDNA阳性患者比例,按GR和MR分组;(右)ctDNA清除率与GR之间的关联
此外,ctDNA清除还可以预测PEPI<4分和RCB<3级,尤其是预测RCB分级方面,早期(T1)就可以实现预测。

ctDNA清除与PEPI(左)和RCB(右)的关联
Biomarker-MammaPrint
尽管在GRs与MRs两组之间未观察到MammaPrint风险分布的差异,但分析显示,MammaPrint高风险患者的RCB和PEPI评分均显著高于低风险患者。除连续评分外,RCB分级与PEPI风险分组也与MammaPrint风险状态呈现显著相关性。值得注意的是,这一发现与新辅助化疗场景下的模式相反——在化疗中,MammaPrint高风险肿瘤通常表现出更高的病理缓解趋势。
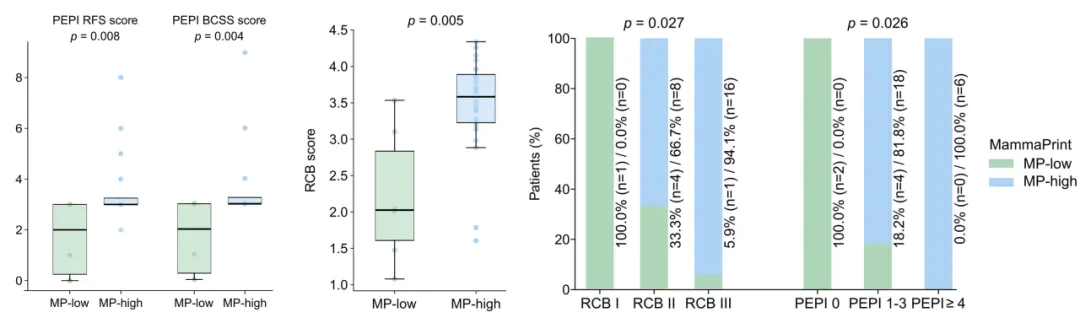
与低风险患者相比,MammaPrint高风险患者表现出更高的PEPI(左)和RCB(中)评分;按RCB分级和PEPI风险分组的MammaPrint高风险比例(右)
Biomarker-Genovariation
基因变异层面,在T0时最常发生突变的基因是PIK3CA(19/30,63.3%)、TP53(14/30,46.7%)和GATA3(10/30,33.3%),并且在S时所有携带这些突变的患者仍然存在这些突变。值得注意的是,CBFB(3/15,20.0%)的突变在MRs中富集,但在GRs中未检测到,并且这种差异在T1和S时持续存在,提示其在DAL-AI耐药中的潜在作用。
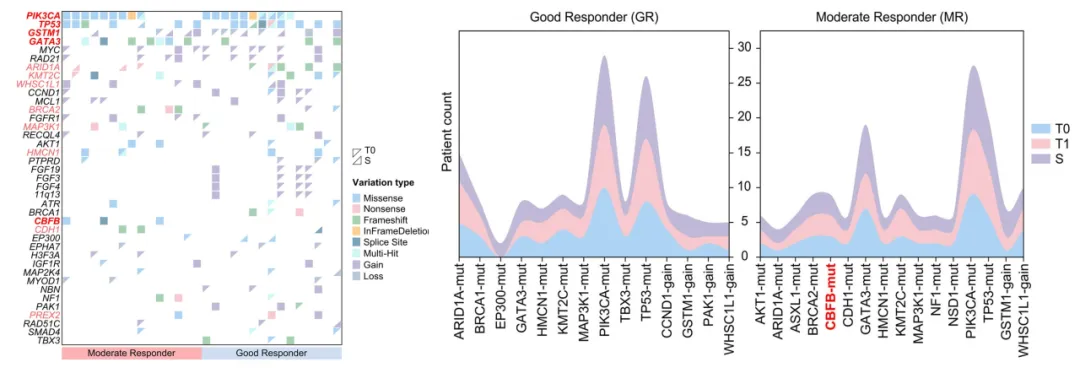
(左)GRs和MRs在T0与S的高频突变基因(≥10%)图谱;(右)GRs与MRs在T0、T1及S时的基因变异时序变化,展示S时变异频率≥13.3%(2/15)的基因
此外,研究还发现GSTM1基因的拷贝数状态与患者对达尔西利新辅助治疗的应答显著相关。基线分析显示,尽管未达统计学显著性,但GSTM1基因缺失在GRs中呈现更高频率。更具启示性的是,在手术样本中观察到GSTM1拷贝数模式的显著动态演变:在基线时存在GSTM1缺失的6例患者中,5例患者该缺失在治疗后(S)已无法检出;与此同时,另有5例患者治疗后出现了新发的GSTM1基因扩增。这一显著的基因组动态变化(p=0.007)提示,达尔西利治疗可能对携带特定GSTM1基因背景的肿瘤细胞群体施加了选择性进化压力,从而驱动了克隆构型的适应性改变。
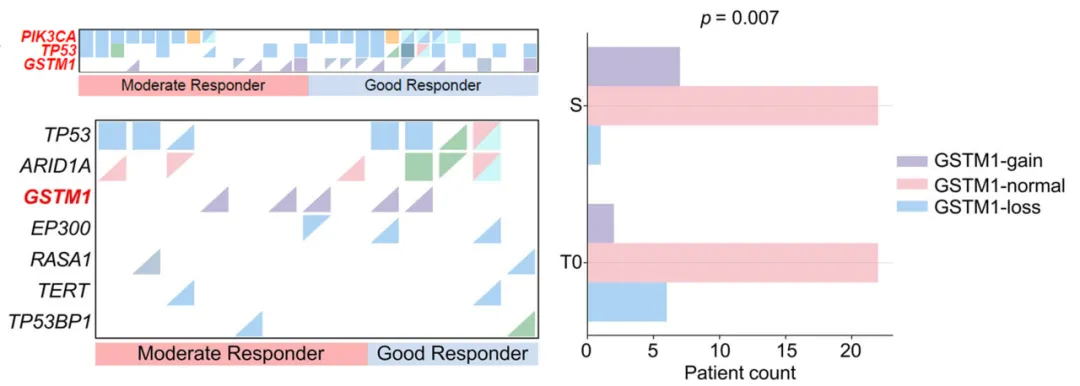
(左上) 基线时GSTM1缺失在GRs中较常见;(左下)手术时5位患者新发GSTM1扩增;(右)达尔西利治疗后GSTM1拷贝数变异模式出现显著变化
Biomarker-Peripheral immunome
血浆蛋白组分析表明,在基线时,GRs血浆中的CCL4和CCL19蛋白水平显著高于MRs,预测良好应答good response的受试者工作特征曲线下面积(AUC)也达到了0.7。
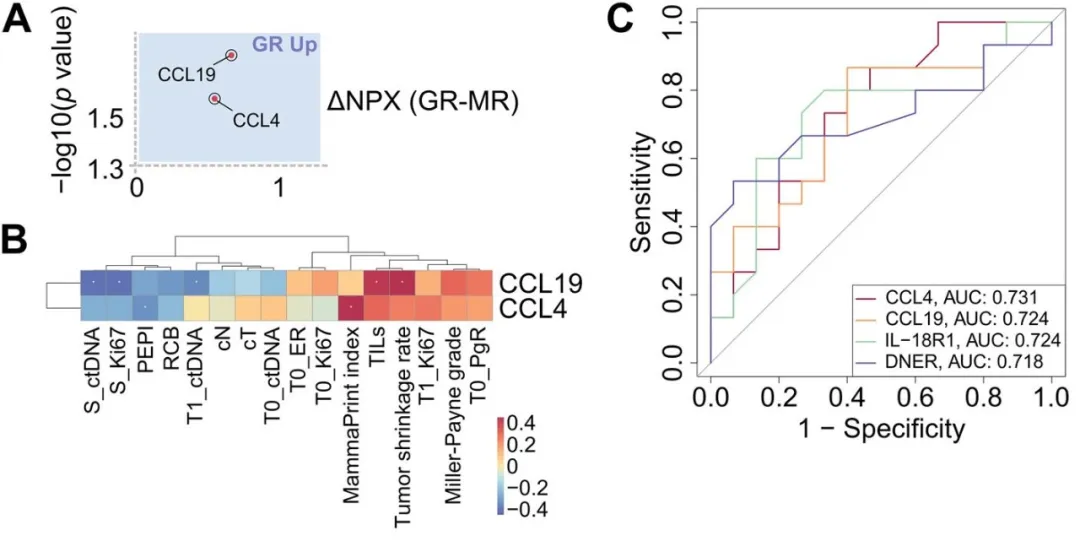
(A)简化火山图展示T0时GRs与MRs间存在显著差异的血浆蛋白;(B)热图显示差异蛋白与临床病理参数间的Spearman相关性分析结果;(C)基于基线血浆蛋白预测GR的ROC曲线,展示p值<0.05的四种蛋白
Biomarker-IHC
基线组织的免疫组化结果则表明,GRs肿瘤组织中的pRb和CDK4蛋白表达水平显著高于MRs。
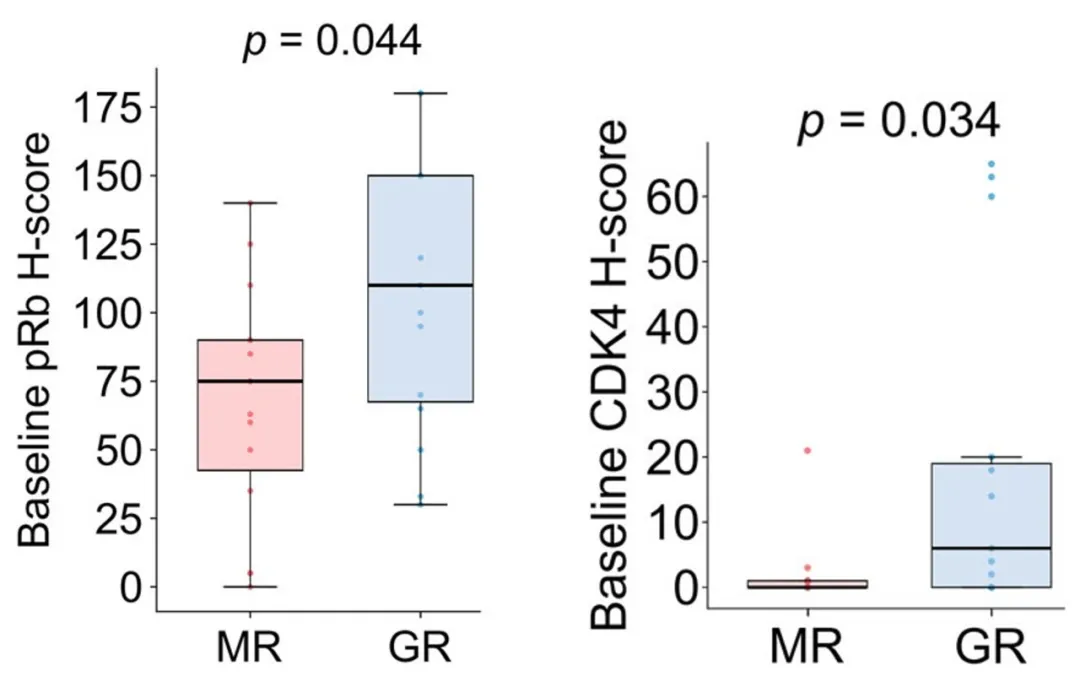
与MRs相比,GRs的pRb(左)和CDK4(右)的基线H-score更高
预测模型BRI
研究者进一步整合关键生物标志物,构建了一个用于预测达尔西利良好应答的基线反应指数(BRI)模型。该模型基于基线血浆CCL4水平与组织pRb蛋白表达建立,其最佳截断值为0.861,AUC达到0.889。模型经过五折交叉验证与自助法(bootstrapping)验证,显示出良好的判别稳定性与可重复性。
尽管该模型基于研究者自定义的“良好应答”标准构建,而非采用目前更广泛认可的病理缓解指标(如RCB或PEPI),但进一步分析显示,基于模型截断值划分的高分组患者,在多个临床相关终点上均表现出显著优势:高分组不仅具有显著更高的良好应答率与肿瘤退缩程度,同时也显示出显著更低的RCB评分、PEPI评分、ctDNA浓度、Ki67指数、组织学分级及CA153水平,提示该模型在识别预后更佳患者方面具有良好的临床判别能力。
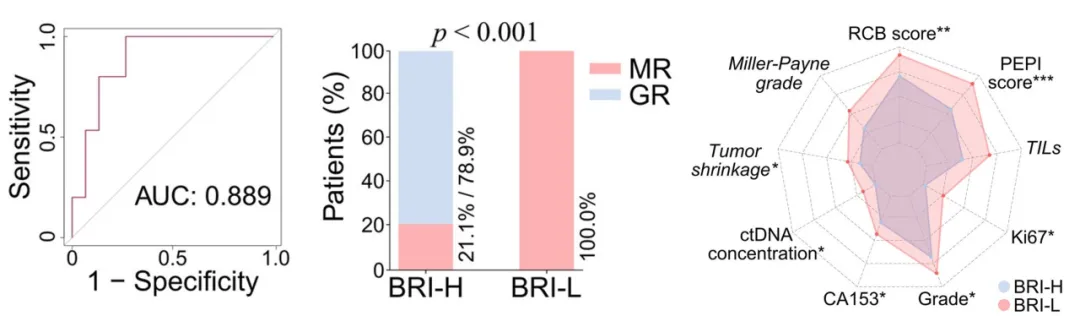
(左)基于BRI预测GR的ROC曲线;(中)按高(n=19)和低(n=11)BRI分层的患者治疗反应;(右)雷达图比较BRI高(BRI-H,n=19)和BRI低 (BRI-L,n=11)患者的手术疗效和预后参数
进一步分析发现,ctDNA动态监测可在BRI分层基础上实现患者的二次筛选:在至少一次ctDNA阳性的11例BRI高分患者中,以及在全部19例BRI高分患者中,T1时间点ctDNA阴性者均表现出更优的病理反应结局。基于此,研究提出一种“BRI初筛-ctDNA动态监测”的二阶分层策略:首先利用基线BRI模型识别潜在获益人群,再通过治疗早期(T1)ctDNA清除情况进一步筛选优势亚组。该策略有望实现ER+/HER2-乳腺癌患者从达尔西利新辅助治疗中的精准获益识别,为个体化治疗决策提供新思路。
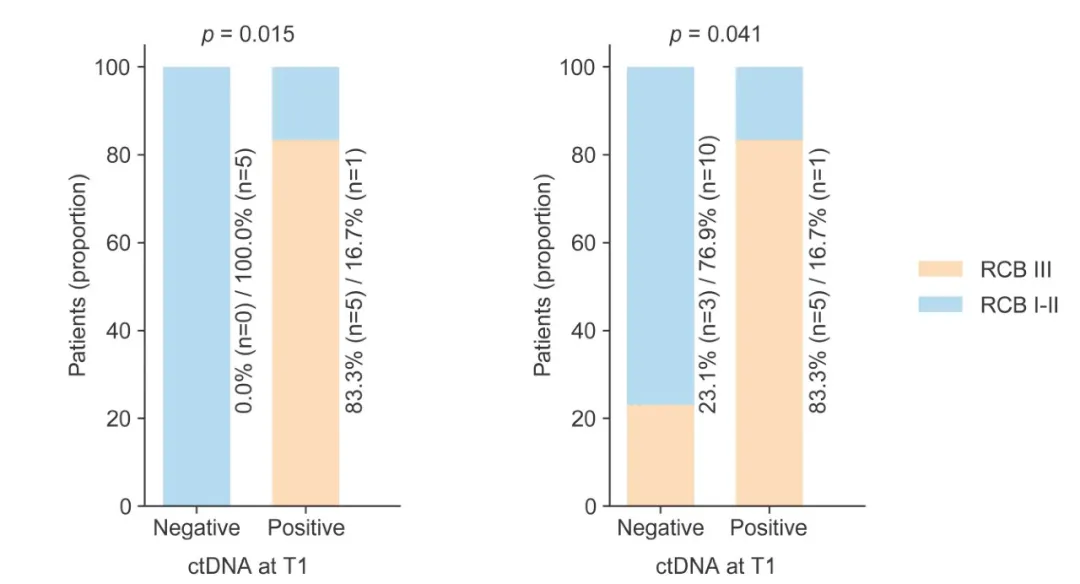
ctDNA对BRI高分人群的预后价值。(左)在至少一次ctDNA阳性的BRI高分患者(n=11);(右)在整个BRI高分亚组(n=19)
研究结论
DANCER研究作为首个探索ctDNA指导CDK4/6抑制剂新辅助治疗的临床研究,证实了达尔西利在ER+/HER2-早期乳腺癌中具有良好的抗肿瘤活性和安全性。通过多时间点多组学分析,研究识别出系列潜在生物标志物,并构建了基于BRI评分与ctDNA动态监测的“二阶预测框架”,为精准筛选获益人群提供了新策略。
点 评
该研究的创新性体现在三方面:首次将ctDNA动态监测用于CDK4/6抑制剂新辅助治疗的早期评估与决策;系统绘制了治疗过程中的动态分子图谱;创新性地提出可指导临床实践的“二阶预测框架”。研究聚焦于化疗疗效有限但临床需求迫切的Luminal B亚型,其前瞻性设计与多维生物标志物分析也体现了方法的科学性。
DANCER研究结果进一步支持了CDK4/6抑制剂在新辅助治疗中的应用潜力,并凸显了生物标志物指导的精准策略在优化乳腺癌治疗中的重要意义。(点击下方阅读原文查看全文)
研究者介绍

陈益定 教授
-
浙江大学医学院附属第二医院,主任医师,乳腺外科主任,博士生导师
-
中国抗癌协会乳腺癌专委会常务委员
-
中国抗癌协会家族遗传性肿瘤专委会常务委员
-
CSCO乳腺癌专家委员会委员
-
中国医促会乳腺疾病分会常务委员
-
浙江省抗癌协会乳腺癌专委会主任委员
-
浙江省医师协会乳腺肿瘤专委会副主委

潘利强 教授
-
浙江大学药学院副院长,浙江大学求是特聘教授/长聘教授,浙二医院兼聘教授
-
国家高层次领军人才、国家重点研发计划“前沿生物技术”专项项目首席科学家、国家高层次青年人才、浙江省特聘专家等
-
2021年《麻省理工科技评论》“35岁以下科技创新35人”亚太区榜单
-
现为浙江省药学会理事及生物制药专委会主委、浙江省抗癌协会肿瘤微环境专委会联合发起人及副主委,STTT期刊编委等。在Cell,PNAS,Nature Comm,JACS等国际知名期刊发表论文40余篇。

周云翔 教授
-
浙江大学医学院附属第二医院乳腺外科,医学博士
-
浙江省抗癌协会乳腺癌专业委员会秘书
-
Clinical and Experimental Obstetrics & Gynecology等期刊编委
-
Military Medical Research期刊科学编辑
-
Frontiers in Immunology等期刊客座编辑
-
Advanced Materials,Advanced Science,iMeta,Advanced Functional Materials,Small,MedComm,Pharmacological Research等50余本期刊审稿人
-
一作(含共同)或通讯发表论文31篇,IF>200,被引2900余次,H指数23
参考文献:
[1] Ades F, Zardavas D, Bozovic-Spasojevic I, et al. Luminal B breast cancer: molecular characterization, clinical management, and future perspectives. J Clin Oncol. 2014;32(25):2794-803.
[2] Sella T, Weiss A, Mittendorf EA, et al. Neoadjuvant Endocrine Therapy in Clinical Practice: A Review. JAMA Oncol. 2021;7(11):1700-1708.
[3] Hurvitz SA, Martin M, Press MF, et al. Potent Cell-Cycle Inhibition and Upregulation of Immune Response with Abemaciclib and Anastrozole in neoMONARCH, Phase II Neoadjuvant Study in HR(+)/HER2(-) Breast Cancer. Clin Cancer Res. 2020; 26(3): 566-580.
[4] Shao Z-M, Hao J, Wang S, et al. Dalpiciclib (Dalp) plus endocrine therapy (ET) as adjuvant treatment for HR+/HER2– early breast cancer (BC): The randomized, phase 3, DAWNA-A trial. J Clin Oncol. 2025; 43(16_suppl): 515-515.
[5] Zhang P, Zhang Q, Tong Z, et al. Dalpiciclib plus letrozole or anastrozole versus placebo plus letroz ole or anastrozole as first-line treatment in patients with hormone receptor-positive, HER2-negative advanced breast cancer (DAWNA-2): a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2023; 24(6): 646-657.
[6] Álvarez-Fernández M, Malumbres M. Mechanisms of Sensitivity and Resistance to CDK4/6 Inhibition. Cancer Cell. 2020;37(4):514-529.
[7] Smith I, Robertson J, Kilburn L, et al. Long-term outcome and prognostic value of Ki67 after perioperative endocrine therapy in postmenopausal women with hormone-sensitive early breast cancer (POETIC): an open-label, multicentre, parallel-group, randomised, phase 3 trial. Lancet Oncol. 2020;21(11):1443-1454.
[8] Dowsett M, Smith IE, Ebbs SR, et al. Proliferation and apoptosis as markers of benefit in neoadjuvant endocrine therapy of breast cancer. Clin Cancer Res. 2006;12(3 Pt 2):1024s-1030s.
[9] Dowsett M, Smith IE, Ebbs SR, et al. Prognostic value of Ki67 expression after short-term presurgical endocrine therapy for primary breast cancer. J Natl Cancer Inst. 2007;99(2):167-70.
[10] Ellis MJ, Suman VJ, Hoog J, et al. Ki67 Proliferation Index as a Tool for Chemotherapy Decisions During and After Neoadjuvant Aromatase Inhibitor Treatment of Breast Cancer: Results From the American College of Surgeons Oncology Group Z1031 Trial (Alliance). J Clin Oncol. 2017;35(10):1061-1069.
[11] Ma CX, Gao F, Luo J, et al. NeoPalAna: Neoadjuvant Palbociclib, a Cyclin-Dependent Kinase 4/6 Inhibitor, and Anastrozole for Clinical Stage 2 or 3 Estrogen Receptor-Positive Breast Cancer. Clin Cancer Res. 2017;23(15):4055-4065.
[12] Magbanua MJM, Brown Swigart L, Ahmed Z, et al. Clinical significance and biology of circulating tumor DNA in high-risk early-stage HER2-negative breast cancer receiving neoadjuvant chemotherapy. Cancer Cell. 2023;41(6):1091-1102.e4.
[13] Magbanua MJM, Swigart LB, Wu HT, et al. Circulating tumor DNA in neoadjuvant-treated breast cancer reflects response and survival. Ann Oncol. 2021;32(2):229-239.
[14] Zhou Q, Gampenrieder SP, Frantal S, et al. Persistence of ctDNA in Patients with Breast Cancer During Neoadjuvant Treatment Is a Significant Predictor of Poor Tumor Response. Clin Cancer Res. 2022;28(4):697-707.
[15] Parsons HA, Blewett T, Chu X, et al. Circulating tumor DNA association with residual cancer burden after neoadjuvant chemotherapy in triple-negative breast cancer in TBCRC 030. Ann Oncol. 2023;34(10):899-906.
[16] rovenzano L, Dieci MV, Curigliano G, et al. Real-world effectiveness comparison of first-line palbociclib, ribociclib or abemaciclib plus endocrine therapy in advanced HR-positive/HER2-negative BC patients: results from the multicenter PALMARES-2 study. Ann Oncol. 2025;36(7):762-774.
* 本文仅供医疗卫生专业人士了解最新医药资讯参考使用,不代表本平台观点。该等信息不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议,如果该信息被用于资讯以外的目的,本公众号及作者不承担相关责任。
Olink及多组学文章发表在NEJM、Nature、Cell、Cancer Celll、STTT等顶刊杂志!
2.联川生物全产品实验CSP资质认证(Olink Target系列、Olink Explore系列、Olink reveal Olink Explore HT等)实验质量有保证!
3.Olink实验经验丰富,截止2025年样本数累计超过5万、累计样本类型超过80种,覆盖已经发表文章样本类型80%,实验质量有保障!
4.Olink蛋白质组学生信专利、19年多组学联合分析经验,为多组学数据联合分析保驾护航!
