简介
微量转录组Smart-seq2技术是一种基于单细胞或极少量RNA样本的高精度转录组测序方法,其核心原理是通过模板转换(template switching)技术实现全长cDNA的高效扩增。该技术通过末端转移酶在反转录产物末端添加寡核苷酸序列,结合PCR扩增,突破了传统方法对样本量的限制,能够从单个细胞或pg级RNA中获取覆盖全转录本的基因表达信息,尤其适用于低丰度RNA的检测。与早期技术相比,Smart-seq2显著提高了测序的灵敏度和准确性,在单细胞基因表达分析、肿瘤异质性研究、胚胎发育追踪等领域具有广泛应用价值,为解析复杂生物系统的分子机制提供了重要工具。
应用场景与案例
应用场景1:差异基因筛选与功能分析
适用范围:临床医学、基础医学、生物化学、动植物及真菌研究等任意方向
利用真核有参转录组测序,可通过比较实验组和对照组基因表达量筛选差异表达的基因。然后对差异表达基因进行进一步锁定,如通过GO、KEGG富集分析及GSEA分析,配合Pubmed中已发表的文献以及课题组中已积累的部分明星分子对差异表达基因进行功能注释,并进一步分析关注的功能基因。进入实验验证阶段后可对筛选到的差异基因进行qPCR、Northern、Western Blot、FISH验证、基因敲除及过表达等。
应用场景2:时序分析或浓度梯度分析
适用范围:临床样本、细胞样本、动植物样本有多个时间段的样本,或不同药物浓度处理的样本
在转录组数据分析过程中,有一类特殊的实验设计。通过对不同时间段的实验样本进行搜集,或测试不同的药物、试剂等浓度梯度的样本进行采集。继而研究不同基因在不同时间段或不同浓度梯度间的表达规律,这一类分析通常称之为“时序分析”
应用场景3:转录因子/调控因子/剪切因子等上游调控基因挖掘
适用范围:临床医学、基础医学、生物化学、动植物研究等任意研究方向
常规转录组差异分析极有可能得到大量的差异基因,这对后期实验验证的目标锁定带来挑战。在没有特定感兴趣的通路及明星分子前提下,转录因子是一个非常不错的切入方向。转录因子可以调节基因组DNA开放性、募集RNA聚合酶进行转录过程、募集辅助因子调节特定的转录阶段,调控诸多生命进程,诸如免疫反应、发育模式等。所以,分析转录因子表达及其调控活性对于解析复杂生命活动具有重要意义。其他调节因子包括可变剪切等调控基因也可以参与上游调控。
应用场景4:大样本研究
适用范围:动植物育种、遗传群体与物种起源、人群队列与生物标志物挖掘
随着测序技术的飞速发展,少量样本的转录组测序研究已经无法解释复杂的生物学问题。研究者们已开始利用大样本量的转录组样本,结合统计学与机器学习等方式,知道符合特定规律和研究目的的核心基因。如孟德尔随机化、相关性分析、线性回归、LASSO回归、Cox回归等,分析不同样本基因或基因组多样性,挖掘更深入和全面的生物学意义。
项目流程图
联川生物微量转录组Smart-seq2技术可以为研究人员提供从样本提取、建库测序、数据分析等一系列完整的服务流程,提供高质量的数据结果,并为后续研究提供强有力的参考依据。

同时联川生物转录组有参云分析目前已全面升级,为客户提供多种分析内容,满足研究人员标准和和个性化的分析需求。

样本起始量与送样建议
|
样本类型 |
起始量 |
|
动物及临床脏器组织/脑组织等 |
>5mg |
|
动物及临床皮肤/骨/血管/脂肪组织等 |
>15mg |
|
原代细胞/细胞系 |
>100个 |
|
中性粒细胞/嗜酸性粒细胞/嗜碱性粒细胞 |
>500个 |
|
总RNA |
>100ng且RIN>7.0 |
|
注意事项: ① 组织样本建议保存在RNAlater、RNAHold、RNAProtect等相关组织保存液中,然后-80℃保存或干冰寄送; ② 细胞样本使用Smart裂解液或TRIzol等裂解液充分裂解之后,-80℃保存或干冰寄送 ③ 更加详细的样本准备指南,请发送邮件至 market@lc-bio.com 索要或联系驻地销售 |
|
生物信息学分析流程与分析内容
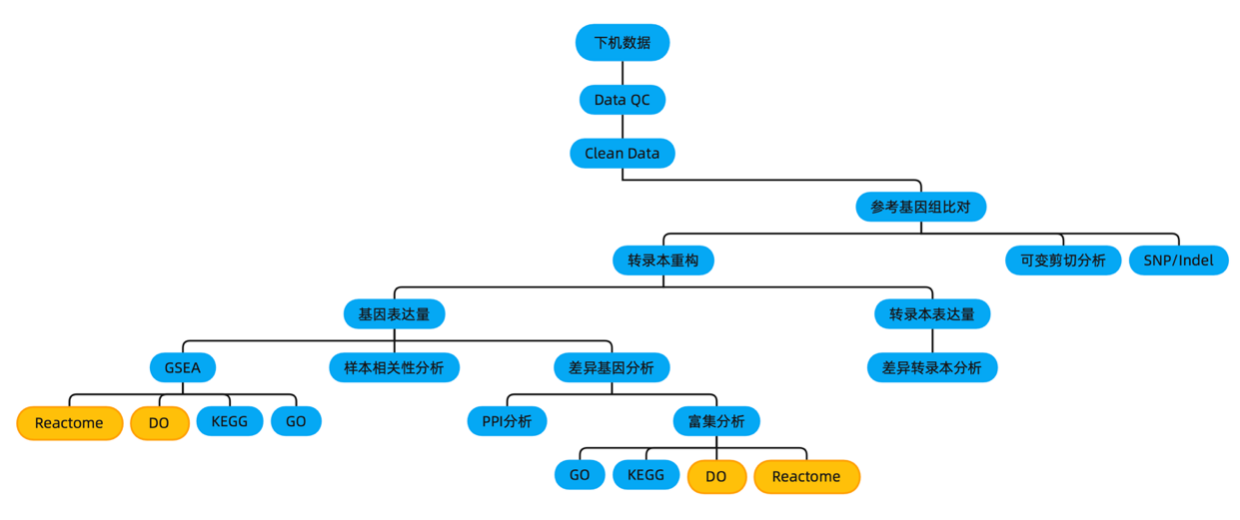
|
Smart-seq2 |
分析内容 |
备注 |
|
测序数据质控 |
去除原始下机数据中的接头序列、污染序列和低质量错误序列 |
|
|
数据量统计和质量评估 |
|
|
|
序列比对和转录本重构 |
参考基因组比对 |
统计下机数据比对上基因组的比例 |
|
参考基因组比对区域分布 |
统计比对上基因组的序列外显子和内含子所占比例 |
|
|
参考序列染色体密度分布 |
染色体上比对序列分布统计 |
|
|
转录本重构 |
包含序列merged.fa和.gtf文件 |
|
|
基因/转录本总体表达分析 |
基因表达总表 |
|
|
转录本表达总表 |
|
|
|
基因和转录本表达量分布盒形图 |
|
|
|
基因和转录本表达量区间分布统计 |
|
|
|
转录本覆盖深度统计 |
|
|
|
基因和转录本表达量分布密度图 |
|
|
|
差异表达基因/转录本分析(样本数≥2) |
差异表达基因和转录本统计柱状图 |
|
|
差异表达基因和转录本表达谱 |
|
|
|
差异表达基因和转录本火山图 |
|
|
|
差异表达基因和转录本聚类热图 |
|
|
|
差异表达基因GO富集分析 |
包含GO富集柱状图、散点图、雷达图等 |
|
|
差异表达基因KEGG富集分析 |
包含KEGG通路富集散点图、通路图、雷达图等 |
|
|
差异表达基因Reactome富集分析(只包含常见19个物种) |
包含Reactome富集散点图、柱状图等 |
|
|
差异表达基因DO(疾病注释数据库)富集分析(只包含物种为人的) |
包含DO数据库富集散点图、柱状图等 |
|
|
结构分析 |
可变剪接分析 |
默认提供ASprofile的可变剪切分析结果,可以售后免费提供rMATS的差异可变剪切分析结果 |
|
SNP/InDel分析 |
|
|
|
样本相关性(样本数≥2) |
相关系数图和PCA(主成分分析)图 |
|
拓展材料——联川生物真核有参转录组测序报告解读及基础知识科普

拓展阅读材料:收藏!看完联川这1万多字的问题解答,你就能从转录组小白变成大神
近期用户文章精选
1. Yang Y., et al. (2025) SAE1 promotes tumor cell malignancy via SUMOylation and liquid–liquid phase separation facilitated nuclear export of p27. Acta Pharmaceutica Sinica B.
2. Andrew E., et al. (2024) Vascular endothelial-derived SPARCL1 exacerbates viral pneumonia through pro-inflammatory macrophage activation. Nature Communications.
3. Lu M., et al. (2024) Dural Tregs driven by astrocytic IL-33 mitigate depression through the EGFR signals in mPFC neurons. Cell Death And Differentiation.
4. Nie C., et al. (2024) MDSCs promote pathological angiogenesis in ocular neovascular disease. Biomedicine & Pharmacotherapy.
5. Li YQ., et al. (2024) Transcriptomic profiling across human serotonin neuron differentiation via the FEV reporter system. Stem Cell Research & Therapy.
6. Xu CF., et al. (2024) Transcriptomic profiling and regulatory pathways of cardiac resident macrophages in aging. Cellular And Molecular Life Sciences.
7. Wang YS., et al. (2023) Study of the inflammatory activating process in the early stage of Fusobacterium nucleatum infected PDLSCs. International Journal of Oral Science.
8. Jiang YR., et al. (2023) Simultaneous deep transcriptome and proteome profiling in a single mouse oocyte. Cell Reports.
9. Li L., et al. (2023) Mettl14-mediated m6A modification ensures the cell-cycle progression of late-born retinal progenitor cells. Cell Reports.
10. Tao Z., et al. (2024) Blockade of CD73 potentiates radiotherapy antitumor immunity and abscopal effects via STING pathway. Cell Death Discovery.
