背景简介
代谢是生命活动的基本特征,代谢组处于生物信息流的中游,介于基因、蛋白质和细胞、组织之间在生物信息的传递中起到承上启下的作用。生物组织的复杂性由多种细胞类型组成,每种细胞类型都有一个异质群体,即每一个细胞都是不同的,不同细胞的代谢也是不同的。因此,开展生物学样本的代谢物成像,将揭示代谢组在组织中的空间分布,对生命科学的研究,具有重要的意义。
空间代谢组学(Spatial Metabolomics)是通过整合质谱成像(Mass Spectrometry Imaging, MSI)与代谢组学分析方法,通过对组织切片进行扫描,直接检测代谢物的空间分布,将定性和定量分子信息与时空信息相结合。这种技术可以将代谢组学的研究从“整体水平”提升到“空间水平”,能够对生物样本中的代谢物进行精准检测,包括其种类、含量及空间分布信息。简单来说,它不仅告诉你样本中有哪些代谢物以及它们的含量,还能告诉你这些代谢物在组织或细胞中的具体分布位置。
空间代谢组学最主流且应用最广泛的技术是MALDI-MSI技术(基质辅助激光解吸电离质谱成像),其将空间分辨分子消融与解吸以及随后基于MS的分子分析相结合:将分析物分散在基质分子中并形成共结晶,当用激光照射晶体时,由于基质分子经辐射吸收能量并导致迅速产热,使基质晶体升华。基质和分析物气化,分析物电离后进入质谱被检测,从而获得样本表面各像素点离子的质荷比和离子强度。与质谱成像软件结合,获得对应离子的信号强度和其在样本表面的位置,绘制出对应分子或离子在样本表面的二维分布图。
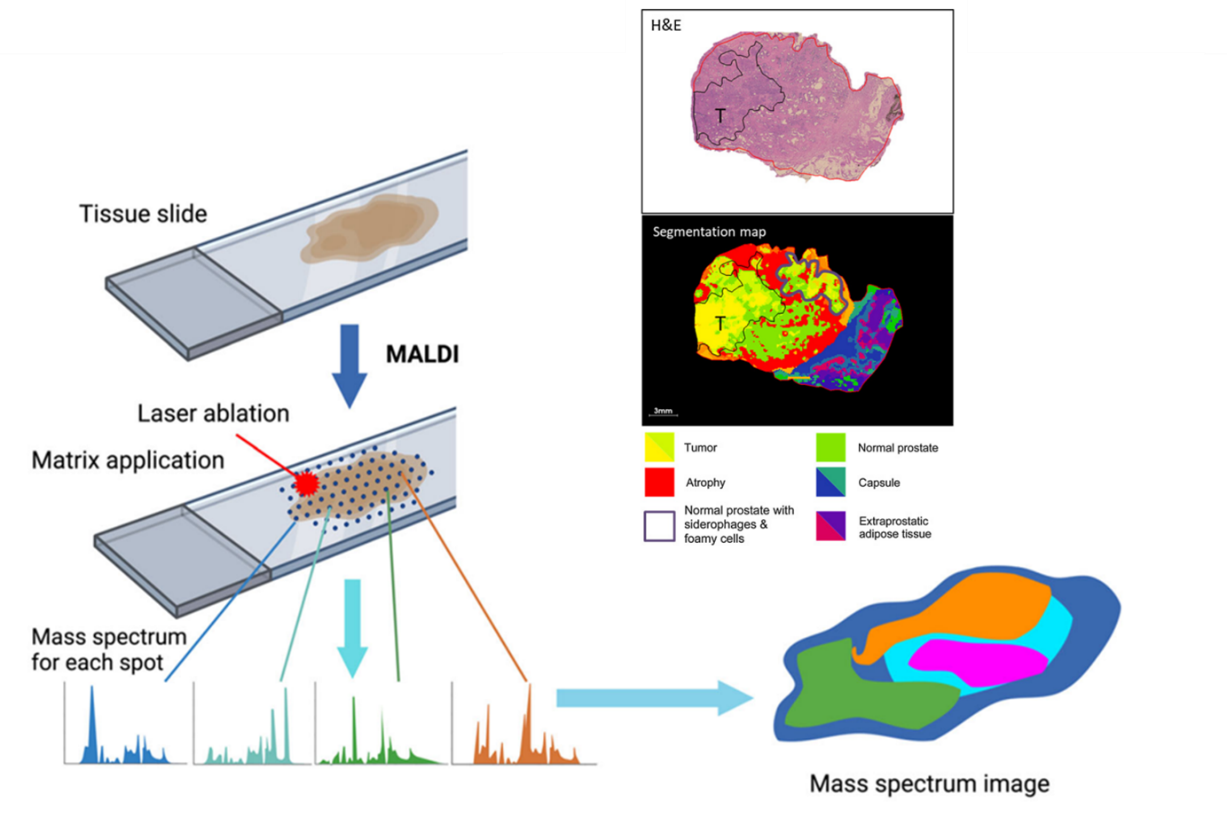
图1 空间代谢组分析
技术优势
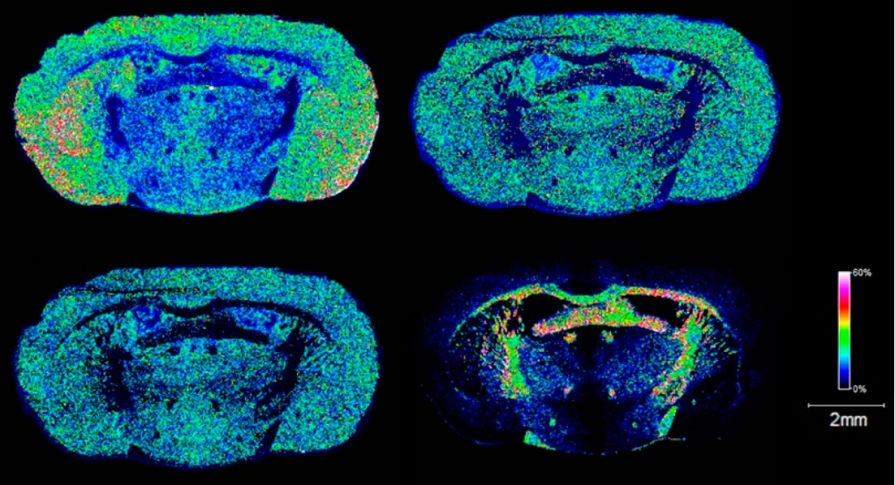
图2 空间代谢组数据展示(大鼠脑冠状面切片)
1. 快速:无需标记,一次分析就可以得到上千种化合物信息。
2. 全参数:同时实现定性、定量和定位检测,获取代谢物的空间分布信息,而且能够提供目标物质的分子结构信息。
3. 高分辨率:光学图像与质谱分析成像的融合,进一步提高了图像分辨率。最高可实现空间上5 μm的分辨。
4. 全面覆盖:对切片区域全面扫描,原位检测不同代谢物的空间含量信息。
技术路线
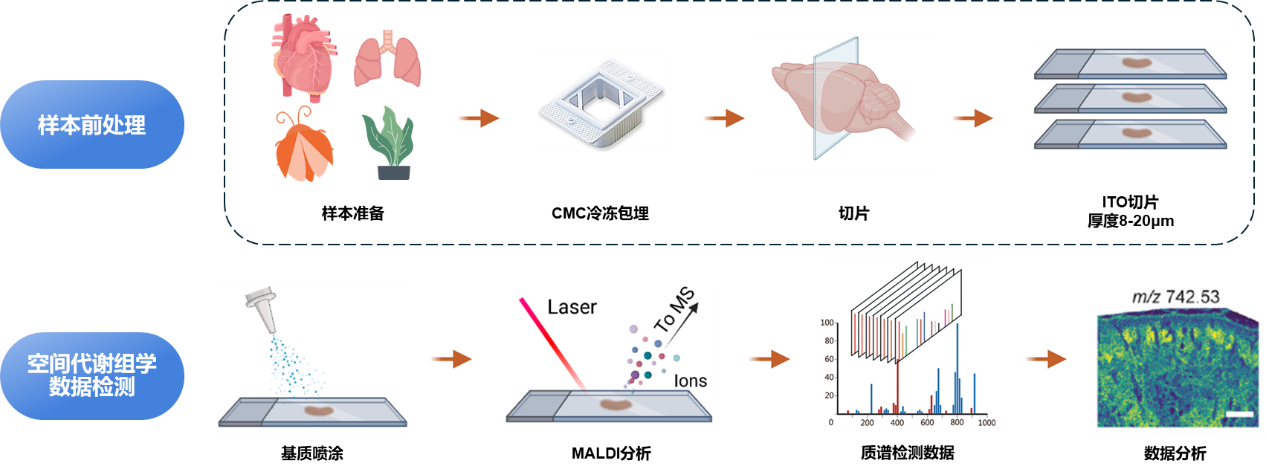
图3 空间代谢组技术路线
1. 样本采集:新鲜样本CMC包埋(纤维素树脂),固定组织样本。
2. 制备冷冻切片:制备ITO(氧化铟锡,一面镀有导电的ITO膜)切片,组织切片须放置在ITO载玻片涂有导电材料的一面。
3. 基质喷涂:全自动基质喷雾仪。默认基质:DHB(2,5-二羟基苯甲酸,最有效的基质辅助激光解吸电离 (MALDI) 基质之一,在紫外激光的不同辐照度下被光电离)。
4. MALDI-MSI检测。
5. 数据分析及可视化:代谢物鉴定、代谢物空间分布、空间分割分析。
送样标准

应用方向
一、肿瘤微环境与疾病机制研究
1. 肿瘤异质性解析
MALDI-MSI可揭示肿瘤区域与正常组织的代谢差异,例如在肾癌研究中发现近端小管上皮细胞中线粒体长链脂肪酸代谢异常,并与肿瘤细胞增殖相关。此外,通过定位脂质、氨基酸等代谢物分布,可解析肿瘤微环境中代谢重编程机制。
2. 神经退行性疾病研究
在帕金森病模型中,MALDI-MSI结合空间转录组技术实现了多巴胺代谢物与基因表达的空间共定位,揭示了黑质区代谢物耗竭与神经元退变的关联。
二、药物研发与药代动力学
1. 药物分布与代谢途径
MALDI-MSI可精准可视化药物及其代谢产物在组织中的分布,如抗肿瘤药物在肝、肾等器官的蓄积情况,为优化给药方案提供依据。案例显示,三七皂苷在根茎“狮子头”结构中的高丰度积累与其药效密切相关。
2. 药效评估与毒性分析
通过对比给药前后代谢物空间图谱的变化,可评估药物对特定组织区域的影响,例如心肌缺血模型中能量代谢物(ATP、乳酸)的分布动态反映药物保护作用。
三、发育生物学与组织代谢调控
1. 胚胎发育与细胞分化
在人类胎儿肾脏发育研究中,MALDI-MSI揭示了近端小管细胞分化过程中糖酵解向氧化磷酸化的代谢转换,并发现特定脂质分子对肾单位形成的调控作用。
2. 植物代谢与发育
应用于三七等药用植物,解析皂苷类成分在根茎不同区域(如皮层与维管束)的积累模式,结合转录组数据阐明“狮子头”形成的代谢调控网络。
四、多组学整合与精准医学
MALDI-MSI与空间转录组(如Visium平台)、蛋白质组(如CODEX)的整合,实现了代谢-基因-蛋白的多维度分析。例如,在肿瘤研究中,通过关联代谢物异常分布与特定基因表达簇,可筛选潜在生物标志物并揭示其调控通路,为个体化治疗提供新靶点。
综上,MALDI-MSI凭借其独特的空间分辨率与多组学兼容性,已成为揭示复杂生物过程代谢机制的核心工具,尤其在疾病机制、药物开发及精准医学领域具有重要价值。
代表性文章
1. Capolupo L, Khven I, Lederer AR, et al. Sphingolipids control dermal fibroblast heterogeneity. Science. 2022;376(6590):eabh1623.
2. Ravi VM, Will P, Kueckelhaus J, et al. Spatially resolved multi-omics deciphers bidirectional tumor-host interdependence in glioblastoma. Cancer Cell. 2022;40(6):639-655.e13.
3. Li H, Li D, Ledru N, et al. Transcriptomic, epigenomic, and spatial metabolomic cell profiling redefines regional human kidney anatomy. Cell Metab. 2024;36(5):1105-1125.e10.
4. Vicari M, Mirzazadeh R, Nilsson A, et al. Spatial multimodal analysis of transcriptomes and metabolomes in tissues. Nat Biotechnol. 2024;42(7):1046-1050.
5. Ji L, Wang D, Zhuo G, et al. Spatial Metabolomics and Transcriptomics Reveal Metabolic Reprogramming and Cellular Interactions in Nasopharyngeal Carcinoma with High PD-1 Expression and Therapeutic Response. Theranostics. 2025;15(7):3035-3054.
