背景简介
近几年,空间组学(Spatial omics)的热度与日俱增。可以说,空间多组学技术已“引爆”科研界。自2020年该技术被Nature Methods评为年度技术方法之后,受到了各领域科学家的全面关注。随着上榜Nature 2022值得年度关注的七大榜单技术,被誉为“生命科学”的下一个风口。
与空间转录组学不同,在空间维度进行蛋白质研究一直是精准功能研究及指导临床转化的重要方向,被 Nature Methods 评为2024年「年度技术」的空间蛋白质组学(spatial proteomics),正接棒空间转录组学的研究风向,以前所未有的分辨率和维度重塑我们对生物系统的理解。
为了收集有限样本中超多指标的空间位置蛋白质信息,Akoya Biosciences创新性的推出了支持超多蛋白检测的PCF(PhenoCycler™-Fusion)蛋白组学分析平台,也被称为CODEX技术,是一种创新性的高通量方法,实现组织样本中在原位空间进行单个细胞层面研究蛋白质表达。PCF平台结合了寡核苷酸标记(Barcode)和微流控自动染色技术,可以实现同一样本100种以上的蛋白标记物的检测及深度分析,并且可以提供单细胞水平的高分辨率空间蛋白质表达分析。
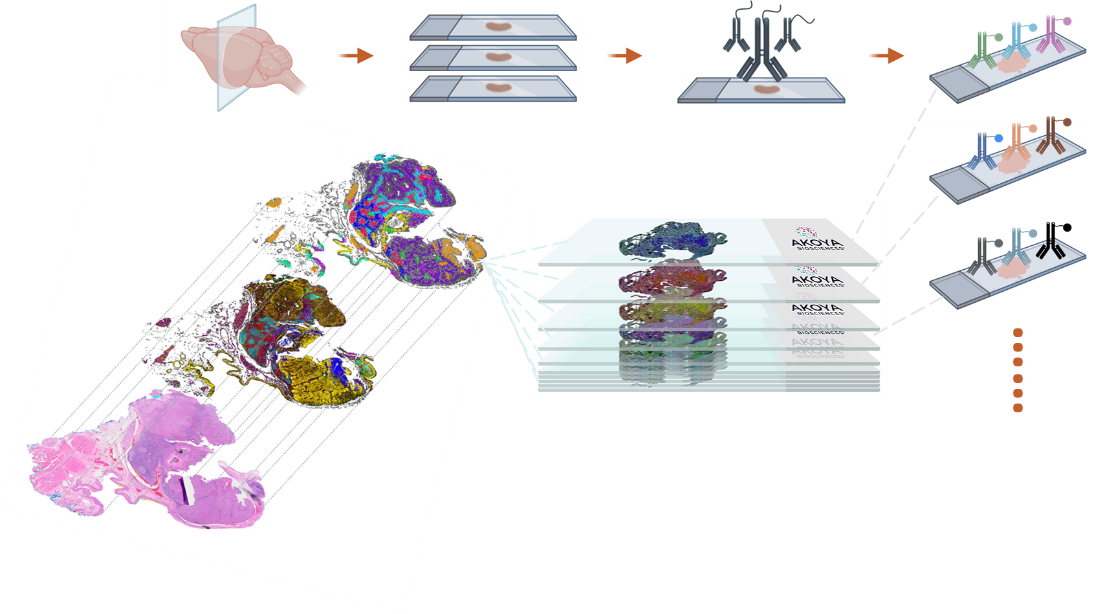
图1 PhenoCycler™-Fusion单细胞原位空间蛋白组分析
技术优势
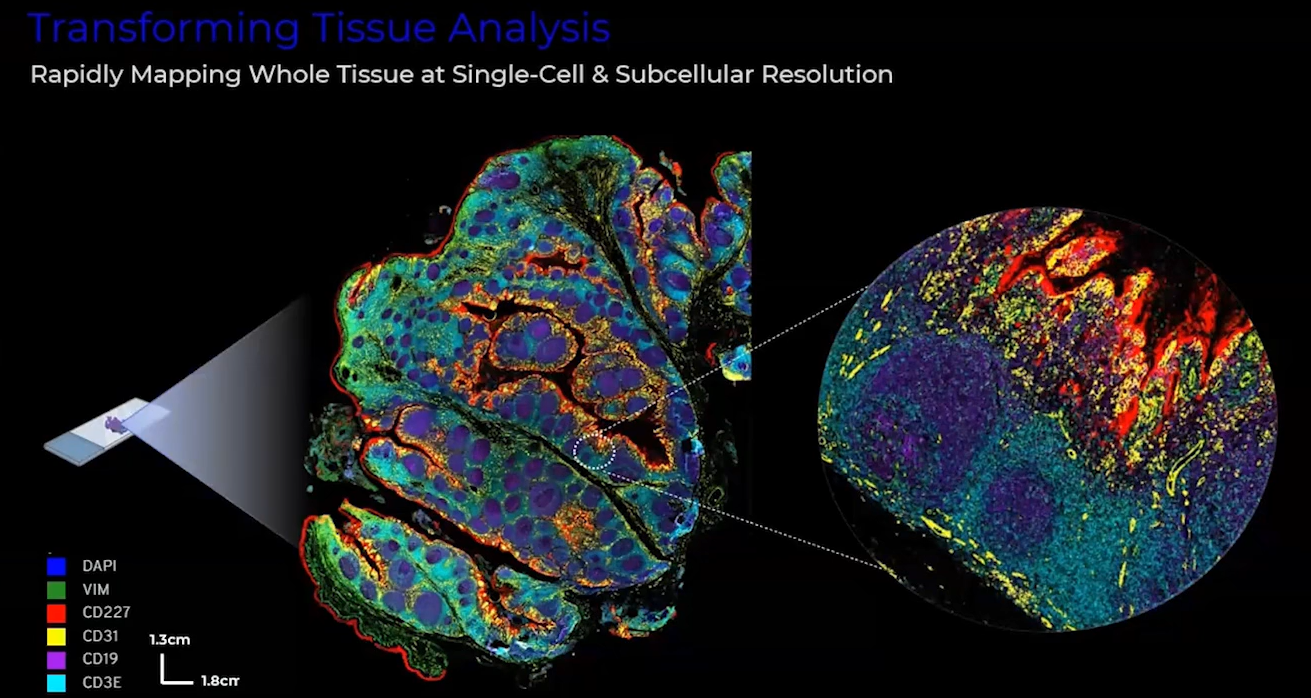
图2 PhenoCycler™-Fusion单细胞原位空间组结果展示
1. 快速:集合了自动化、超多重生物标志物检测和高速成像的优势,10 分钟内可描绘记录 100 万细胞的蛋白质原位表达信息,比以往任何时候都快速的扩大空间蛋白质发现。
2. 高精度:可实现真正单细胞甚至亚细胞水平的原位空间蛋白质表达分析,其分辨率可达0.25 μm,解决细胞组成在空间上的异质性。
3. 客观:空间生物学的真正潜力要得以实现,需要能看到整张组织切片上每一个细胞。PCF实现跨越整张组织切片的无偏差记录,可在空间原位中精准定位某个细胞,而不会遗漏任何细节。
4. 超高参数:同时成像高达100个蛋白质,发现更多的生物标志物和更精确的细胞表型。
5. 高通量:单周实现100+张样本拍摄,帮助研究大量的群体,并找到统计上显著的结果。
6. 可实现空间多组学联合:100%组织信息的全景空间内容分析,同时支持蛋白和RNA组织原位检测。
技术路线
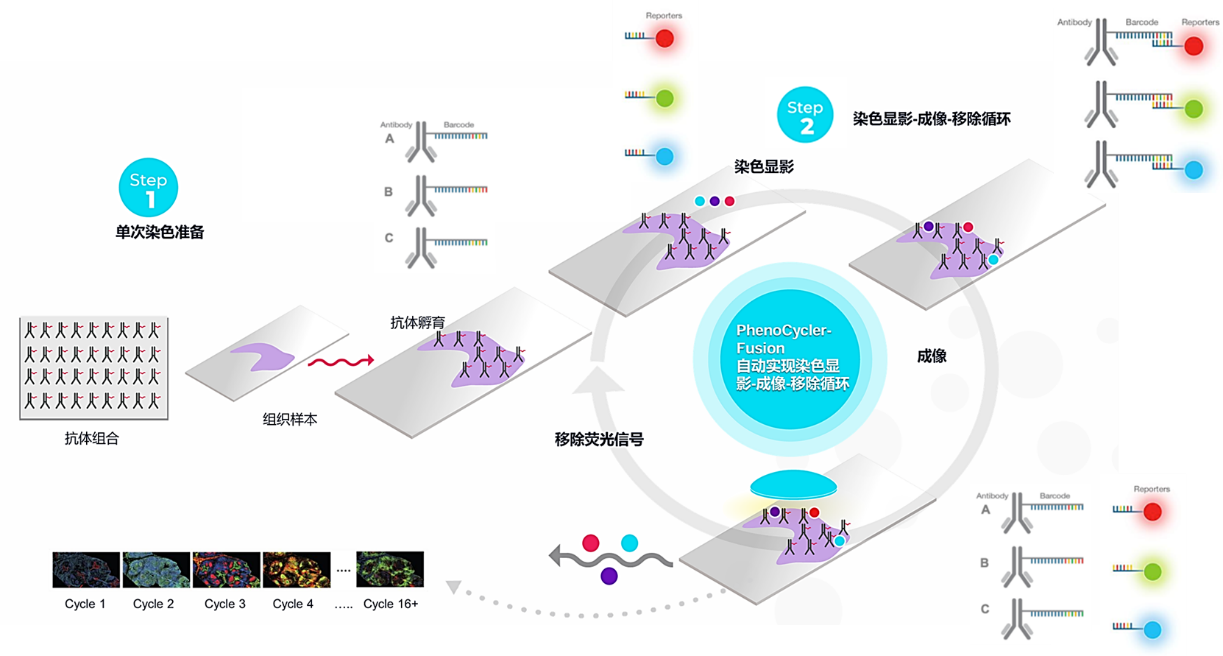
图2 PhenoCycler™-Fusion单细胞原位空间组技术路线
1. 把检测的抗体 panel 与切片进行孵育。孵育的过程中抗体就会结合到相应的抗原上;
2. 开始进行第一轮的杂交显色。加入第一组 3 个荧光报告探针进行杂交,这 3 个探针针对 3 个不同的蛋白上结合的抗体,并且这 3 个探针分别发出不同颜色的荧光。杂交好之后,用显微镜对切片进行拍照成像。
3. 接下来,把第一轮结合上的报告探针洗掉。这样,第一轮的杂交显色就全部完成了。在这一轮的杂交中,检测到了 3 种蛋白。
4. 然后进入第二轮的杂交显色。加入第二组的 3 个荧报告探针。把杂交、拍照、洗脱的这个过程重复再做一遍。
5. 检测到第二轮的 3 种蛋白。再接着,做三轮、第四轮,直到第 N 轮的杂交显色。这样,经过多轮的杂交显色,就可以把一个 panel 中所针对的全部蛋白都检测到。
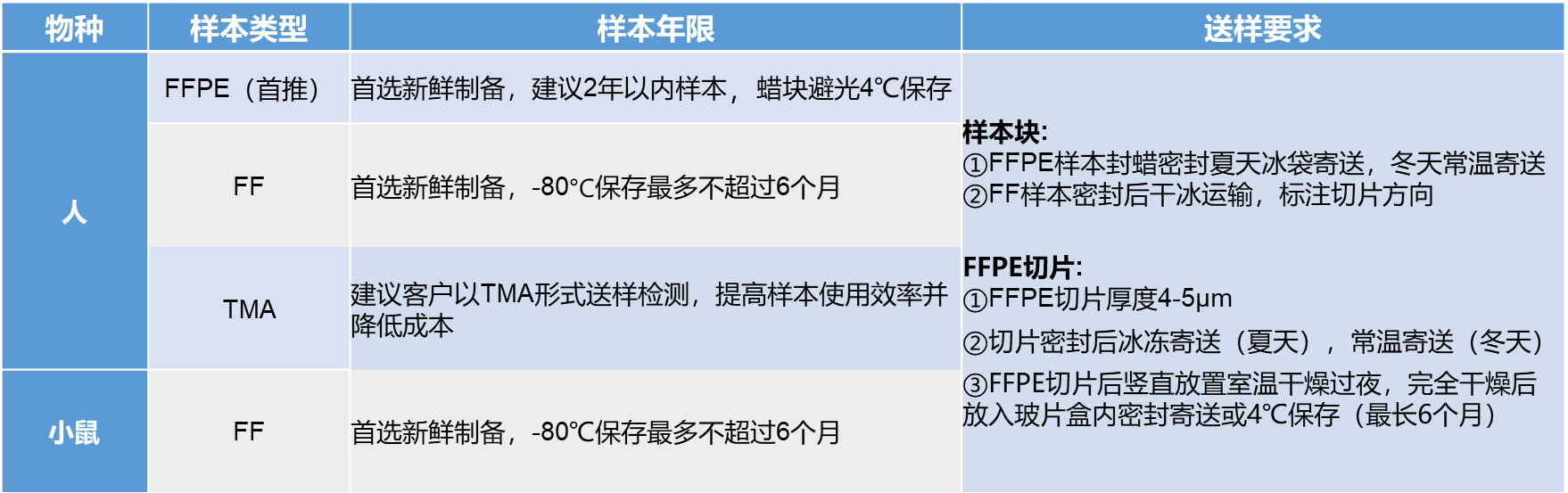
送样标准
应用方向
空间蛋白组学技术PCF作为一种高精度、高通量的原位分析工具,在生物医学研究中展现出多方面的应用潜力,尤其在肿瘤微环境解析、免疫治疗机制研究和多组学整合领域具有显著价值:
1. 肿瘤微环境与免疫互作研究
PCF通过同时检测100种以上蛋白标志物,可精准解析肿瘤组织中免疫细胞、基质细胞与肿瘤细胞的空间分布及动态互作。例如,在《Nature》发表的研究中,结合单细胞核RNA测序、空间转录组和CODEX技术,揭示了肿瘤演进中免疫抑制微环境的形成机制,并识别出与免疫检查点抑制剂响应相关的细胞邻域特征。斯坦福大学团队进一步利用CODEX追踪过继T细胞治疗后CD8+ T细胞周围微环境变化,发现PD-L1+巨噬细胞与肿瘤细胞的空间富集动态与治疗抵抗性相关,为优化免疫疗法提供了空间表型依据。
2. 多组学整合与三维空间分析
PCF在泛癌种研究中被用于构建2D和3D空间多组学图谱,例如通过分析6种肿瘤类型的3D空间数据,揭示了克隆演化过程中“冷/热”微区域的分子异质性。在2025年《Cancer Cell》发表的小细胞肺癌研究中,CODEX与CosMx空间转录组联合应用,开发出ColonyMap算法,系统性鉴定了与临床预后密切相关的“MT2”亚结构,其空间异质性特征可作为免疫治疗响应预测标志物。
3. 技术验证与标准化应用
作为空间组学领域的“金标准”,CODEX的高稳定性(FFPE样本中>95%蛋白检出率)和低背景噪音(非特异性结合率<1%)使其成为评估其他平台(如Stereo-seq、Visium HD)性能的关键工具。研究显示,其蛋白质信号与转录组数据的空间一致性(如CD3E定位R>0.8)为多组学数据整合提供了可靠基准。
4. 细胞图谱构建与临床转化
在人类乳腺细胞图谱(HBCA)项目中,CODEX从蛋白层面验证了单细胞转录组推定的8种主要细胞类型,其空间分布特征与smFISH结果高度一致。此类研究为疾病特异性生物标志物发现和精准医疗策略开发奠定了基础,例如通过识别肿瘤边界与核心的蛋白表达差异,指导靶向治疗方案的优化。
综上,CODEX技术的核心价值在于将蛋白质表达与空间定位信息相结合,为复杂生物系统的机制解析和临床转化研究提供了不可替代的技术路径。
1. Ruf B, Bruhns M, Babaei S, et al. Tumor-associated macrophages trigger MAIT cell dysfunction at the HCC invasive margin. Cell. 2023;186(17):3686-3705.e32.
2. Shiao SL, Gouin KH 3rd, Ing N, et al. Single-cell and spatial profiling identify three response trajectories to pembrolizumab and radiation therapy in triple negative breast cancer. Cancer Cell. 2024;42(1):70-84.e8.
3. Bandyopadhyay S, Duffy MP, Ahn KJ, et al. Mapping the cellular biogeography of human bone marrow niches using single-cell transcriptomics and proteomic imaging. Cell. 2024;187(12):3120-3140.e29.
4. Mo CK, Liu J, Chen S, et al. Tumour evolution and microenvironment interactions in 2D and 3D space. Nature. 2024;634(8036):1178-1186.
5. Chen H, Deng C, Gao J, et al. Integrative spatial analysis reveals tumor heterogeneity and immune colony niche related to clinical outcomes in small cell lung cancer. Cancer Cell. 2025;43(3):519-536.e5.
